某混合金属粉末 除Mg外还含有Al Zn中的一种或两种 含量都在10%以上。某研究小组设计实验探究该
| 某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。 所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。 该小组探究过程如下: ●查阅资料:
(1)假设①:该混合金属粉末中除镁外还含有铝元素; 假设②:该混合金属粉末中除镁外还含有锌元素; 假设③: 。 ●实验探究: 甲同学基于假设③设计实验方案如下:  乙同学同样基于假设3设计另一实验方案如下: 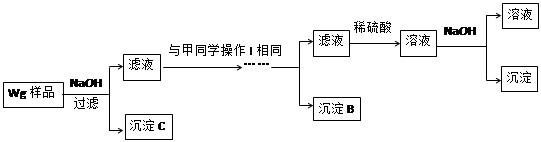 (2)试剂M是________________;沉淀B是 。 (3)丙同学认为乙同学的方案比甲同学的好,理由是 。 (4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。 (5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。 (6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。 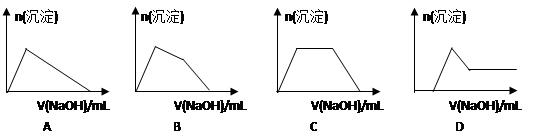 |
参考解答
| (1)该混合金属粉末中除镁外还含有铝、锌元素 (2)NaOH溶液;Al(OH)3 (3)步骤简单,节约试剂;(4)将沉淀C洗涤、小心干燥后称量;(5)稀硫酸;稀氨水;(6)B |
试题分析:(1)由于混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,实验根据假设①②可知,假设③应该是该混合金属粉末中除镁外还含有铝、锌元素。 (2)样品与稀硫酸反应生成相应的硫酸盐。由于氢氧化锌、氢氧化铝均能和氢氧化钠溶液反应,所以首先加入过量的氢氧化钠溶液得到氢氧化镁沉淀,而锌离子和铝离子分别是生成相应的偏铝酸盐,即M是氢氧化钠溶液,沉淀A是氢氧化镁。由于Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O,但氢氧化铝不能溶于氨水中,所以可以向滤液中先加入酸将偏铝酸盐转化为锌离子和铝离子,然后加入过量的氨水得到氢氧化铝白色沉淀,而锌离子转化为[Zn(NH3)4]2+,所以沉淀B是氢氧化铝。由于Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,所以向滤液中加入稀硫酸即可生成Zn2+、NH4+,最后加入适量的氢氧化钠溶液生成氢氧化锌沉淀。 (3)由于锌(Zn)、铝均可以与NaOH溶液反应生成H2,所以在乙方案中首先加入过量的氢氧化钠溶液,将锌和铝溶解,而镁不溶解,即沉淀C是镁。而后续的操作与甲方案是相同的,所以乙同学的方案比甲同学的好,理由是步骤简单,节约试剂。 (4)由于在乙方案中沉淀C就是镁,所以只需要将沉淀C洗涤、小心干燥后称量即可得出镁的含量。 (5)根据以上分析可知,操作Ⅰ的主要过程是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,最后再加入足量的氨水即可生成氢氧化铝白色沉淀。 (6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则首先生成氢氧化锌、氢氧化铝沉淀。由于氢氧化锌能溶解在氨水中,所以加入的氢氧化钠首先溶解氢氧化锌,然后氢氧化钠再与溶液中的NH4+反应,最后加入的氢氧化钠再和氢氧化铝反应而使其溶解,因此生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是B。 |
相似问题
完成下列实验所需选择的装置或仪器都正确的是( )
完成下列实验所需选择的装置或仪器都正确的是( )
下列实验操作不正确的是( )A.NaCl溶液蒸发结晶时 蒸发皿中有晶体析出并剩余少量液体时即停止
下列实验操作不正确的是()A.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热B.除去Fe(OH)3胶体中混有的Cl?离子,可用渗析的方法C
海洋植物如海带 海藻中含有丰富的碘元素 碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下:(1
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下:(1)指出提取碘的过程中有关实验操作的名称: ①
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜 再以粗铜为原料制备硫酸铜晶体。完成下列填空:(1)
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。完成下列填空:(1)气体A中的大气污染物可选用下列试剂中的(填序号)吸收。
某化学兴趣小组以工业碳酸钙(含少量Al2O3 Fe2O3 SiO2等杂质)生产二水合氯化钙晶体(Ca
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为:(1)CaCO3与盐酸反应的离子方程式。(2)加












