某化学兴趣小组以工业碳酸钙(含少量Al2O3 Fe2O3 SiO2等杂质)生产二水合氯化钙晶体(Ca
某化学兴趣小组以工业碳酸钙(含少量Al2O3、Fe2O3、SiO2等杂质)生产二水合氯化钙晶体(CaCl2·2H2O)的操作流程为: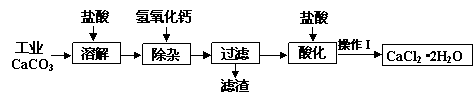 (1)CaCO3与盐酸反应的离子方程式 。 (2)加入氢氧化钙溶液调节溶液的pH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 ,若用氢氧化钠溶液除杂则产品中可能混有的物质为 。 (3)酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是 。 (4)操作Ⅰ中应包括①蒸发浓缩②冷却结晶③过滤④ ⑤ 等实验步骤。 (5)为测定样品中CaCl2·2H2O的含量,称取7.350 g样品配成200.0 mL溶液,与205.0 mL 0.5000 mol/LAgNO3溶液恰好完全反应。 ①样品中CaCl2·2H2O的质量分数为 。 ②若计算出结果有明显偏差,你认为在操作Ⅰ的五个步骤中由 引起的(填序号),理由是 。 |
参考解答
| (1)CaCO3+2H+=Ca2++CO2↑+H2O(1分) (2)①Al(OH)3、SiO2、Fe(OH)3(1分)NaCl(1分) (3)除去过量的氢氧化钙(1分,合理则给分); (4)洗涤;干燥(各1分) (5)①.102.5﹪(2分) ②.⑤(1分);干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分) |
试题分析:⑴CaCO3与盐酸反应的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O,答案:CaCO3+2H+=Ca2++CO2↑+H2O;⑵第一次反应的生成物有氯化钙、氯化钠、氯化铁和氯化铝,第二次反应加入过量氢氧化钙溶液,与氯化铁和氯化铝反应生成氢氧化铁沉淀和氢氧化铝沉淀.故滤渣中的主要成份是氢氧化铁沉淀和氢氧化铝沉淀;加入过量氢氧化钙溶液后,不能与氯化钙、氯化钠反应,故滤液中含有氯化钙、氯化钠和剩余的氢氧化钙,加入盐酸,与氢氧化钙反应生成氯化钙,因此最后蒸发结晶后得到的氯化钙中一定含有少量的氯化钠.答案:①Al(OH)3、SiO2、Fe(OH)3(1分)NaCl(1分);⑶酸化时加盐酸将溶液的pH调节到4.0左右,其主要目的是除去过量的Ca (OH)2,答案:除去过量的氢氧化钙;⑷从溶液中获得晶体一般要经过①蒸发浓缩②冷却结晶③过滤④洗涤⑤干燥等步骤。答案:洗涤;干燥 ⑸①解:设样品中含CaCl2 ·2H2O的质量为Y 根据氯原子守恒得到如下关系式: CaCl2 ·2H2O ~ 2AgCl 147 2 Y 0.2050 L ×0.5000 mol/L Y='7.5338' g 样品中含CaCl2 ·2H2O的质量分数='7.5338g/7.350g*100%=102' .5% 答:样品中含CaCl2 ·2H2O的质量分数为102.5% ②计算结果明显有误差,产生的原因可能是⑤中干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分)。 答案:①.102.5﹪(2分) ②.⑤(1分);干燥时温度过高时CaCl2·2H2O 晶体失去部分结晶水(合理则给分) |
相似问题
将下列各组物质提纯分离或除杂 可采用相同的实验方法和原理的是 A.除去苏打中混有的少量小苏打杂质;除
将下列各组物质提纯分离或除杂,可采用相同的实验方法和原理的是 A.除去苏打中混有的少量小苏打杂质;除去氯化钠中混有的碘单质B.分离硝酸钾与氯化钠
有五瓶失去标签的溶液 分别为Na2CO3 AgNO3 BaCl2 HCl及NH4NO3。为鉴别它们
有五瓶失去标签的溶液,分别为Na2CO3、AgNO3、BaCl2、HCl及NH4NO3。为鉴别它们,取其中一种溶液分别与剩余的4种溶液反应,则下列结论错误的是A.若有三支
除去NaNO3中少量NaCl Ca(NO3)2杂质 所用试剂及其顺序正确的是A.AgNO3 Na2C
除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及其顺序正确的是A.AgNO3、Na2CO3、HNO3B.AgNO3、Na2CO3、HClC.Na2CO3、AgNO3、HNO3D.AgNO3、K2CO3、HNO3
如图 在盛有碘水的三支试管中分别加入苯(密度比水小 不溶于水) 四氯化碳和酒精 振荡后静置 出现下
如图,在盛有碘水的三支试管中分别加入苯(密度比水小,不溶于水)、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论有( )A.①加入的是CCl4,②
将碘水中的碘萃取出来的实验中 下列说法错误的是 A.分液漏斗使用前要检查它是否漏水B.萃取剂要求不溶
将碘水中的碘萃取出来的实验中,下列说法错误的是 A.分液漏斗使用前要检查它是否漏水B.萃取剂要求不溶于水,且比水更容易使碘溶解 C.注入碘水和萃取












