现从锌制品加工企业回收的废渣(含有ZnO FeO Fe2O3 CuO Al2O3等杂质)来制取氧化锌
现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下: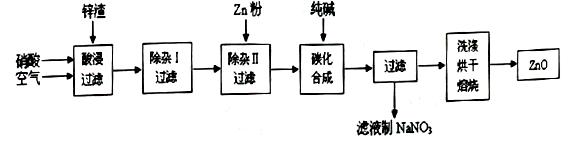 有关氢氧化物完全沉淀的pH见下表:
(l)在酸浸过程中,要提高锌元素的浸出率,可以采取 措施。 (2)上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。 (3)在“除杂I”步骤中,将溶液调至pH=4的目的是 。在“除杂II”后,溶液的pH约为6,则此步过滤时滤渣中含有 。 (4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式 。 (5)从滤液中提取NaNO3晶体的操作步骤为 。 (6)在实验室如何洗涤过滤出的碱式碳酸锌? 。 |
参考解答
| (16分) (1)加热、搅拌(2分) (2)烧杯、玻璃棒、漏斗 (3分) (3)使Fe3+转化为Fe(OH)3沉淀除去(2分) Al(OH)3、Cu、Zn (2分) (不填Zn不扣分) (4)2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑(2分) (5)蒸发浓缩、冷却结晶、过滤(3分) (6)往漏斗中加入少量蒸馏水,浸没沉淀,让其自然滤出,反复几次(2分) |
试题分析:(1)增大反应物浓度、升高温度、增大压强(有气体参加的反应)、增大固体表面积、使用合适的催化剂、研磨、搅拌、振荡等措施,都是加快反应速率、提高浸出率的常用措施;(2)过滤分离固液混合物,常用的玻璃仪器有烧杯、普通漏斗、玻璃棒;(3)硝酸具有强氧化性和强酸性,酸性条件下空气中的氧气也能将亚铁离子氧化为铁离子,则溶液中含有Zn2+、Fe3+、Cu2+、Al3+、H+、NO3-,读表中信息可知,将溶液pH调至4时,铁离子完全变为氢氧化铁沉淀,可以除去溶液中的铁离子;将溶液pH调至6时,铝离子完全变为氢氧化铝沉淀,可以除去溶液中的铝离子,由于锌比铜活泼,则加入过量的锌不仅能消耗氢离子,而且能将铜离子完全还原为单质铜,既除去杂质,又没有引入新杂质,则除杂II所得滤渣主要成分为氢氧化铝、铜、锌;(4)依题意,加入的碳酸钠与硝酸锌溶液反应,生成碱式碳酸、二氧化碳,根据质量守恒原理可得该复分解反应方程式:2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;(5)硝酸钠是可溶性盐,溶解度随温度下降而明显减小,根据其性质推断,将滤液蒸发浓缩、冷却结晶、过滤得到硝酸钠晶体;(6)根据过滤之后洗涤沉淀的一般原理,洗涤碱式碳酸锌时,先向漏斗中加入少量蒸馏水,浸没沉淀,再让其自然滤出,反复几次即可。 |
相似问题
下列实验操作中正确的是( )A.蒸馏操作时 应向蒸馏烧瓶中加入几块沸石 以防止暴沸B.蒸发操作时 应
下列实验操作中正确的是()A.蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热C.蒸发
下列离子检验的方法正确的是A.某溶液生成白色沉淀 说明原溶液中有Cl-B.某溶液生成白色沉淀 说明原
下列离子检验的方法正确的是A.某溶液生成白色沉淀,说明原溶液中有Cl-B.某溶液生成白色沉淀,说明原溶液中有SO42-C.某溶液生成红褐色沉淀,说明原溶
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回
实验中常用Na2CO3溶液 NaOH溶液 BaCl2溶液作为除杂试剂除去粗盐中含有的泥沙 Ca2+
实验中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂除去粗盐中含有的泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质。下列除杂试剂添加顺序不合理的是A.N
下列实验操作中错误的是A.分液时 分液漏斗中下层液体从下口放出 上层液体从上口倒出B.蒸馏时 应使温
下列实验操作中错误的是A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口C.蒸发氯化钠溶液












