已知氧化还原反应:NaNO2+NH4Cl——NaCl+H2O+N2↑ 若得到m mol的N2 则电子
| 已知氧化还原反应:NaNO2+NH4Cl——NaCl+H2O+N2↑,若得到m mol的N2,则电子转移数为__________个,此时氧化产物与还原产物的质量之比为____________。 |
参考解答
| 3MnA 1∶1 |
从反应方程式可知NaNO2中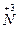 被还原成零价,NH4Cl中 被还原成零价,NH4Cl中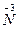 被氧化成零价,所以很快可以配平,即:NaNO2+NH4====ClNaCl+N2+2H2O,当得到m mol N2,电子转移数目为3m NA;由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量之比为1∶1。 被氧化成零价,所以很快可以配平,即:NaNO2+NH4====ClNaCl+N2+2H2O,当得到m mol N2,电子转移数目为3m NA;由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量之比为1∶1。 |
相似问题
在下列两个反应中被氧化的氯元素与被还原的氯元素的质量之比各为多少?(1)2Cl2+2Ca(OH)2=
在下列两个反应中被氧化的氯元素与被还原的氯元素的质量之比各为多少?(1)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O(2)3Cl2+6KOH5KCl+KClO3+3H2O
黑火药发生反应2KNO3+S+3C====K2S+N2↑+3CO2↑中 被还原的元素是( )A.
黑火药发生反应2KNO3+S+3C====K2S+N2↑+3CO2↑中,被还原的元素是()A.氮和氧B.碳C.氮和硫D.氮和碳
将铁粉加入到一定量的硝酸银 硝酸铜及硝酸锌的混合溶液中 待充分反应后过滤 在滤渣中加入稀盐酸 没有气
将铁粉加入到一定量的硝酸银、硝酸铜及硝酸锌的混合溶液中,待充分反应后过滤,在滤渣中加入稀盐酸,没有气体产生,则在滤液中( )A.只有硝酸锌和水B.
下列说法正确的是[ ]A.置换反应一定属于氧化还原反应B.分解反应均不属于氧化还原反应C.复
下列说法正确的是[ ]A.置换反应一定属于氧化还原反应B.分解反应均不属于氧化还原反应C.复分解反应有的属于氧化还原反应D.化合反应一定属于氧化还原反应
下列氧化还原反应的方程式配平正确的是( )A.Fe3++ S2-====Fe2++SB.Fe3+
下列氧化还原反应的方程式配平正确的是()A.Fe3++ S2-====Fe2++SB.Fe3++Fe= "===2 " Fe2+C.Fe2++Cl2====Fe3++2 Cl-D.2 Fe3++2I-= "===2 " Fe2++I2












