草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与
| 草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题: Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。 (1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有 。 (2)探究分解得到的固体产物中铁元素的存在形式。 ①提出假设 假设1: ; 假设2:FeO; 假设3:FeO和Fe的混合物。 ②设计实验方案证明假设3。 限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2 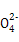 +3Mn +3Mn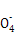 +24H+ +24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为: 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。 ②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。 ③重复以上实验1~2次。 若某小组的一次测定数据记录如下:V1=" 18.90" mL,V2="6.20" mL。根据数据计算0.20 g样品中:n(Fe2+)= ; n(C2 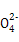 )= ;FeC2O4的质量分数为 (精确到0.01%)。 )= ;FeC2O4的质量分数为 (精确到0.01%)。 |
参考解答
| Ⅰ.(1)CO2、CO (2)① Fe ②
|
| Ⅰ.(1)根据CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉,可判断有CO气体,根据A中澄清石灰水变浑浊,可判断有CO2气体。 (2)①根据后面的假设2和假设3为Fe、FeO中的一种或两种可知,假设1为Fe。 ②要证明假设3是FeO和Fe的混合物,证明Fe的存在可通过Fe与硫酸铜发生置换反应生成红色的铜;第一步中,硫酸铜过量,已经将Fe除去,因此在固体中再加盐酸和H2O2 ,如果有FeO,则会被氧化为Fe3+,遇到KSCN溶液呈血红色。 Ⅱ.根据电子守恒找出关系式:5Fe2+~Mn 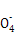 ,5C2 ,5C2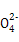 ~2Mn ~2Mn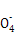 ,故n(Fe2+)=5n(Mn ,故n(Fe2+)=5n(Mn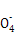 )='5×0.006' 200 L×0.020 00 mol/L='0.000' 620 0 mol,n(C2 )='5×0.006' 200 L×0.020 00 mol/L='0.000' 620 0 mol,n(C2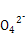 )='5×(0.018' 90-0.006 20)L×0.020 00 mol/L÷2='0.000' 635 0mol。因此n(FeC2O4)=n(Fe2+)='0.000' 620 0 mol,故其质量分数为0.000 620 0mol×144 g/mol÷0.2g×100%=44.64%。 )='5×(0.018' 90-0.006 20)L×0.020 00 mol/L÷2='0.000' 635 0mol。因此n(FeC2O4)=n(Fe2+)='0.000' 620 0 mol,故其质量分数为0.000 620 0mol×144 g/mol÷0.2g×100%=44.64%。 |
相似问题
三氟化氮是微电子工业中优良的等离子刻蚀气体 它在潮湿的环境中能发生如下反应:。下列有关该反应的说法正
三氟化氮是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:。下列有关该反应的说法正确的是A.是还原剂B.非极性分子,在潮湿空气
代硫酸钠可用作脱氯剂 已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下
代硫酸钠可用作脱氯剂,已知25 0 mL 0 1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2O32-转化成( )A.S2-B.SC.SO32-D.SO42-
电解饱和食盐水的反应为2NaCl+2H2OCl2↑+H2↑+2NaOH。27. 在上述方程式上标出电
电解饱和食盐水的反应为2NaCl+2H2OCl2↑+H2↑+2NaOH。27 在上述方程式上标出电子转移的方向和数目。28 该反应中被氧化的元素是。阴极产物之一为H2,
1.76克铜镁合金完全溶解于50mL 密度为1.40g/cm3 质量分数为63%的浓硝酸中 得到NO
1 76克铜镁合金完全溶解于50mL、密度为1 40g cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1 0mol LNaOH溶
有关氧化还原反应实质的说法中正确的是[ ]A.是否有元素的电子转移 B.是否有元素的化合价的
有关氧化还原反应实质的说法中正确的是[ ]A.是否有元素的电子转移 B.是否有元素的化合价的变化C.是否有氧元素的参加 D.是否有原子的重新组合












