已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O (1)该反应的离子
| 已知:化学反应3Ag+ 4HNO3 (稀)= 3AgNO3+ NO↑+ 2H2O (1)该反应的离子方程式为:_________________________________ ____ (2)当有32.4克银溶解时,反应生成的NO在标况下的体积是多少? (3)当有0.2mol银溶解时,有多少克HNO3被还原? |
参考解答
| (1)3Ag+4H++NO3-=3Ag++NO↑+2H2O (2)2.24L (3)4.2g |
| 考查根据方程式进行的有关计算。 (1)根据化学方程式可知,该反应的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。 (2)32.4g银是324g÷108g.mol=0.3mol,所以根据方程式可知生成NO是0.1mol,标准状况下的体积是2.24L。 (3)0.2mol银失去0.2mol电子。稀释在反应中得到3个电子,所以被还原的硝酸是 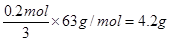 。 。 |
相似问题
某混合溶液中所含离子的浓度如下表 则M n+离子及a值可能为所含离子NO3–SOH+Na+M n+浓
某混合溶液中所含离子的浓度如下表,则M n+离子及a值可能为所含离子NO3–SOH+Na+M n+浓度(mol L)3121aA.Fe2+、2 B.Ba2+、0 5 C.Al3+、1 5 D.Mg2+、1
实验室制取少量N2 常利用的反应是:NaNO2+NH4ClNaCl+N2↑+2H2O 关于该反应的说
实验室制取少量N2,常利用的反应是:NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是A.NaNO2是氧化剂,发生还原反应B.生成1mol N2时转移的电子
氮的某氧化物中 氮元素与氧元素的质量比为7:20 此氧化物中氮的化合价为( )A.+1B.+2C
氮的某氧化物中,氮元素与氧元素的质量比为7:20,此氧化物中氮的化合价为()A.+1B.+2C.+3D.+5
(3分)酸性条件下 许多氧化剂可使KI溶液中的I-氧化 例如KIO3(IO3-→I2) H2O2(H
(3分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中 氧化剂与还原剂的质量之
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中,氧化剂与还原剂的质量之比是 A.1︰1B.1︰5 C.5︰1D.3︰2












