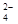某混合溶液中所含离子的浓度如下表 则M n+离子及a值可能为所含离子NO3–SOH+Na+M n+浓
某混合溶液中所含离子的浓度如下表,则M n+离子及a值可能为
|
参考解答
| D |
| 根据溶液中离子电荷守恒,正电荷总数=负电荷总数,可推断,需要满足,n×a=2。所以正确答案选D。 |
相似问题
实验室制取少量N2 常利用的反应是:NaNO2+NH4ClNaCl+N2↑+2H2O 关于该反应的说
实验室制取少量N2,常利用的反应是:NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是A.NaNO2是氧化剂,发生还原反应B.生成1mol N2时转移的电子
氮的某氧化物中 氮元素与氧元素的质量比为7:20 此氧化物中氮的化合价为( )A.+1B.+2C
氮的某氧化物中,氮元素与氧元素的质量比为7:20,此氧化物中氮的化合价为()A.+1B.+2C.+3D.+5
(3分)酸性条件下 许多氧化剂可使KI溶液中的I-氧化 例如KIO3(IO3-→I2) H2O2(H
(3分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中 氧化剂与还原剂的质量之
反应 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O中,氧化剂与还原剂的质量之比是 A.1︰1B.1︰5 C.5︰1D.3︰2
(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4 方法如下:软锰矿与过量固体KOH和K
(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去