(16分)MnO2与过量固体KOH和KClO3在高温下反应 生成锰酸钾(K2MnO4)和KCl K2
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下: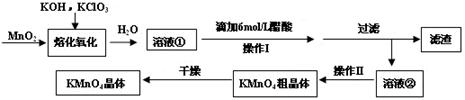 (1)写出“溶化氧化”的化学反应方程式: ; (2)从溶液②中得到KMnO4粗晶体的方法是 ; (3)上述流程中可以循环使用的物质是 ; (4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4; (5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因: ①不采用盐酸的原因: ; ②不采用硫酸的原因: 。 (6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法: ①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ; ②电解K2MnO4溶液,电解的总反应离子方程式为 。 |
参考解答
(1)6KOH + KClO3 + 3MnO2 3K2MnO4 + KCl + 3H2O (3分) 3K2MnO4 + KCl + 3H2O (3分)(2)蒸发浓缩、冷却结晶、过滤 (2分) (3)MnO2 (2分) (4)2/3 (2分) (5)①盐酸具有还原性,高锰酸钾具有强氧化性,会产生氯气 (1分) ②硫酸钾溶解度降低,在蒸发浓缩过程中容易析出而造成产品高锰酸钾纯度下降(1分) (6)2MnO42- + Cl2 = 2MnO4- + 2Cl-(2分) 2MnO42- + 2H2O = 2MnO4- + 2OH- + H2↑(3分) |
试题分析(1)第一步从流程中找到反应物和部分生成物,再根据电荷守恒配平相应变价的元素,最后用电荷守恒进一步配平即可 (2)关键在于审题“溶液②中得到KMnO4粗晶体” (3)可循环物质为可以从“加进去”和“析出来”的物质进行考滤 (4)根据6KOH + KClO3 + 3MnO2 = 3K2MnO4 + KCl + 3H2O 和 3MnO42- + 4H+ = 2MnO4- + MnO2 ↓+ 2H2O 建立关系式:3MnO2~ 3MnO42-~ 2MnO4- 根据系数进行计算即可 (5)①由制氯气的方法盐酸与高锰酸钾反应可知 ②由给出的溶解度“硫酸钾的溶解度为11.1g”可知 (6)①由题意可知,锰酸钾要转化为高锰酸钾要被氧化,而氯气则充当氧化性 ②锰酸钾要转化为高锰酸钾,则锰酸根要在阳极放电,根据锰酸钾溶液的离子成份,类似于电解饱和食盐水。 |
相似问题
有Fe2+ Fe3+ H2O和H+六种粒子 分别属于同一氧化还原反应中的反应物和生成物 下列叙述
有Fe2+、、Fe3+、、H2O和H+六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述错误的是( )A.氧化剂与还原剂的物质的量之比为8∶1B.
汽车剧烈碰撞时 安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判断正确的是A.反应中KNO3为还原剂B.NaN3中氮元素为-3价C.标准状况下,若
工业上以铬铁矿(主要成分为FeO·Cr2O3) 碳酸钠 氧气和硫酸为原料生产重铬酸钠(Na2Cr2O
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:①4FeO·Cr2O3+8Na2CO3+7O28Na2CrO4
将18 g铜和铁的混合物投入200 mL稀硝酸中 充分反应后得到标准状况下2.24 L NO 剩余9
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2 24 L NO,剩余9 6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又
硫代硫酸钠可作为脱氯剂 已知25.0 mL 0.100 mol·L-1Na2S2O3溶液恰好把224
硫代硫酸钠可作为脱氯剂,已知25 0 mL 0 100 mol·L-1Na2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-,则S2O42—将转化为( )A.S2-B.SC.SO32—D.SO42—












