工业废水中常含有一定量的Cr2O72-和CrO42- 它们会对人类及生态系统产生很大的伤害 必须进行
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为: 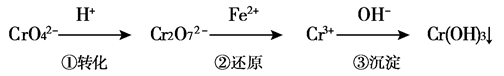 其中第①步存在平衡:2CrO42-(黄色)+2H+  Cr2O72-(橙色)+H2O Cr2O72-(橙色)+H2O(1)若平衡体系的pH=12,则溶液显 色。 (2)能说明第①步反应达平衡状态的是 。 a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同 c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变 (3)第②步反应中,还原剂为 ,该还原剂反应后生成 。 (4)电镀废液中Cr2O72-还可通过下列反应转化: Cr2O72-(aq)+2Pb2+(aq)+H2O(l)  2 PbCrO4(s)+2H+(aq) ΔH< 0 2 PbCrO4(s)+2H+(aq) ΔH< 0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 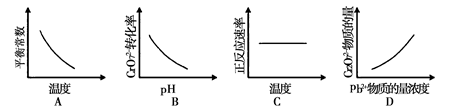 |
参考解答
| (1)黄色 (2)a d (3)Fe2+ Fe3+ (4)A |
试题分析:(1)由2CrO42-(黄色)+2H+  Cr2O72-(橙色)+H2O可在,在碱性溶液中,铬元素是以CrO42-(黄色)的形态存在于溶液中,所以若平衡体系的pH=12,则溶液显黄色;(2)Cr2O72-的浓度不变或者是溶液的颜色不变可以说明反应达到平衡,而Cr2O72-和CrO42-的浓度相同只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,2v(Cr2O72-)=v(CrO42-)也只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,故本题选择ad;(3)第②步反应中,用Fe2+作为还原剂,Fe2+被氧化为Fe3+;(4)Cr2O72-(aq)+2Pb2+(aq)+H2O(l) Cr2O72-(橙色)+H2O可在,在碱性溶液中,铬元素是以CrO42-(黄色)的形态存在于溶液中,所以若平衡体系的pH=12,则溶液显黄色;(2)Cr2O72-的浓度不变或者是溶液的颜色不变可以说明反应达到平衡,而Cr2O72-和CrO42-的浓度相同只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,2v(Cr2O72-)=v(CrO42-)也只是过程中的一个特殊时刻,不能用来判断反应是否达到平衡,故本题选择ad;(3)第②步反应中,用Fe2+作为还原剂,Fe2+被氧化为Fe3+;(4)Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0,该反应为放热反应,所以温度越大,平衡常数越小,故A正确;pH越大,Cr2O72-的转化率越大,故B错误;温度升高,化学反应速率增大,所以C错误;Pb2+物质的量浓度越大,Cr2O72-物质的量浓度越小,所以D错误。 2 PbCrO4(s)+2H+(aq) ΔH< 0,该反应为放热反应,所以温度越大,平衡常数越小,故A正确;pH越大,Cr2O72-的转化率越大,故B错误;温度升高,化学反应速率增大,所以C错误;Pb2+物质的量浓度越大,Cr2O72-物质的量浓度越小,所以D错误。点评:本题考查了化学平衡,氧化还原反应,该题有一定的综合性,但是本题难度不大。 |
相似问题
美蓝(主要成分是亚甲蓝)有较强的还原性 可用做亚硝酸盐中毒的解毒剂 已知亚硝酸盐中毒原理是它会使普通
美蓝(主要成分是亚甲蓝)有较强的还原性,可用做亚硝酸盐中毒的解毒剂,已知亚硝酸盐中毒原理是它会使普通血红蛋白中的铁元素由二价变为三价,失去携氧
仔细阅读下列三段文字①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定 易转化为
仔细阅读下列三段文字①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液
(6分)二氧化硒(Se)是一种氧化剂 其被还原后的单质硒可能成为环境污染物 通过与浓HNO3或浓H2
(6分)二氧化硒(Se)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:(1)Se和浓HNO3反
(1)请将下列五种物质:KBr Br2 I2 KI K2SO4分别填入下列横线上 组成一个未配平的化
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:KBrO3+________+H2SO4―→________+________+___
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M; 关于该反应的说法中正确的组合是()①氧化剂是H3A












