已知:还原性HSO3¯>I¯ 氧化性IO3¯> I2。在含3 mol
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是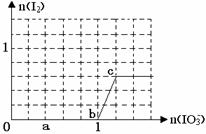
|
参考解答
| D |
试题分析:根据图像可知,o-b阶段没有单质碘生成,因此反应的离子方程式是3HSO3- + IO3-= 3SO42- + I- + 3H+,A正确;亚硫酸氢钠总计是3mol,所以d点对应的亚硫酸氢钠是3mol÷5×2=1.2mol,B正确;根据氧化性可知,IO3-能氧化I-生成单质碘,所以选项C正确;b点碘酸钾的物质的量是1mol,生成碘离子也是1mol。根据反应式IO3-+5I-+6H+=3I2+3H2O可知,如果设此时消耗碘离子的物质的量是x,则消耗碘酸钾就是x/5,生成单质碘是3x/5,所以有(1-x)︰3x/5=5∶2,解得x=0.4,所以加入的的碘酸钾是1+x/5=1.08mol,选项D不正确,答案选D。 点评:如果氧化剂和不同的还原剂混合时,氧化剂首先氧化还原性最强的还原剂,然后依次进行,据此可以判断氧化还原反应的先后顺序。 |
相似问题
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN- +8OH-+5Cl2= 2CO2 +N2
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN- +8OH-+5Cl2= 2CO2 +N2 +10Cl- +4H2O 下列判断正确的是A.当有0 2 mol CO2生成时,溶液中
Na2FeO4是一种高效多功能水处理剂 应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O + 2
铜和镁的合金4.6g完全溶于浓硝酸 若反应中硝酸被还原只产生4480mL的NO2气体和336mlN2
铜和镁的合金4 6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mlN2O4(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠
(8分)(1)已知离子反应:+6I—+6H+=R—+3I2+3H2O n=_____ R元素在中的化
(8分)(1)已知离子反应:+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在中的化合价是_____。(2)化学实验中,如使某步中的有害产物作为另一步的反应物,
在实验室中 常用KMnO4代替MnO2与浓盐酸反应制取氯气 其反应的化学方程式为 2KMnO4+16
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是()A.












