KMnO4与质量分数为36.5%的浓盐酸溶液反应 反应方程式如下:2KMnO4+16HCl=2KCl
| KMnO4与质量分数为36.5%的浓盐酸溶液反应,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O (1)盐酸在反应中体现了______性和______性. (2)用双线桥标出电子转移的方向和数目______. (3)反应中氧化剂与还原剂的物质的量之比为______,15.8氧化剂参加反应,被氧化的还原剂的质量为______g. (4)若反应转移5mol电子,则生成的氯气在标准状况下的体积为______L. |
参考解答
| (1)HCl中Cl元素的化合价升高,且该反应中生成盐酸盐,则该反应体现了HCl具有还原性和酸性, 故答案为:还原;酸; (2)Mn元素的化合价由+7降低为+2价,Cl由-1升高为0,则双线桥标出电子转移的方向和数目为 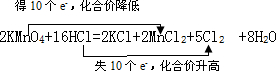 , 故答案为: 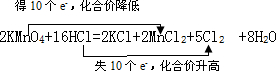 ; (3)KMnO4为氧化剂,HCl为还原剂,由2KMnO4~10HCl可知氧化剂与还原剂的物质的量之比为2:10=1:5,15.8氧化剂参加反应,其物质的量为
(4)由反应可知5Cl2~10e-,反应转移5mol电子,则生成氯气为2.5mol,在标准状况下的体积为为2.5mol×22.4L/mol=56L,故答案为:56. |
相似问题
下列反应中氯元素只被还原的是( )A.5Cl2+I2+6H2O=10HCl+2HIO3B.2Cl2
下列反应中氯元素只被还原的是( )A.5Cl2+I2+6H2O=10HCl+2HIO3B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OC.MnO2+4HCl=MnCl2+2H2O+Cl2↑D.2NaCl+2H2O电解 2NaOH+Cl2↑+H2↑
高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.(1)KMn
高锰酸钾是锸的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.(1)KMn04是______(填颜色)的晶体,其稀溶液是一种常用
在海水中提取溴的反应原理是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O
在海水中提取溴的反应原理是5NaBr+NaBrO3+3H2SO4=3Br2+3Na2SO4+3H2O下列反应的原理与上述反应最相似的是( )A.2NaBr+Cl2=2NaCl+Br2B.2FeCl3+H2S=2F
氢气还原氧化铜:CuO+H2 △ . Cu+H2O 在该反应中( )A.Cu做还原剂B.CuO
氢气还原氧化铜:CuO+H2△ Cu+H2O,在该反应中( )A.Cu做还原剂B.CuO做氧化剂C.铜元素的化合价降低D.铜元素化合价升高
关于氧化还原反应的说法中正确的是( )A.氧化还原反应的本质是电子得失或偏移B.失去电子的物质是氧
关于氧化还原反应的说法中正确的是( )A.氧化还原反应的本质是电子得失或偏移B.失去电子的物质是氧化剂C.原子得到电子后,元素的化合价一定升高D












