在900℃的空气中合成出一种含镧 钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物 其中锰可能以
| 在900℃的空气中合成出一种含镧、钙和锰 (摩尔比2 : 2 : 1) 的复合氧化物,其中锰可能以 +2、+3、+4 或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析: ⑴ 准确移取25.00 mL 0.05301 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5 mL 6 mol·L-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75 mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。 ⑵ 准确称取0.4460 g复合氧化物样品,放入锥形瓶中,加25.00 mL上述草酸钠溶液和30 mL 6 mol·L-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。 |
参考解答
| ⑴2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2 + 8H2O KMnO4溶液浓度: 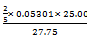 =' 0.01910' (mol·L-1) =' 0.01910' (mol·L-1)⑵根据:化合物中金属离子摩尔比为 La : Ca : Mn =' 2' : 2 : 1,镧和钙的氧化态分别为+3和+2,锰的氧化态为 +2 ~ +4,初步判断 复合氧化物的化学式为La2Ca2MnO6+x, 其中x = 0~1。 滴定情况: 加入C2O42-总量:25.00 mL ×0.05301 mol·L-1=' 1.3253' mmol 样品溶解后,滴定消耗高锰酸钾:10.02 mL ×0.01910 mol·L-1 =' 0.1914' mmol 样品溶解后剩余C2O42-量: 0.1914 mmol ×  =' 0.4785' mmol =' 0.4785' mmol样品溶解过程所消耗的C2O42-量: 1.3253 mmol -0.4785 mmol =' 0.8468' mmol 在溶样过程中,C2O42-变为CO2给出电子: 2 × 0.8468 mmol =' 1.694' mmol 有两种求解x的方法: (1)方程法: 复合氧化物(La2Ca2MnO6+x)样品的物质的量为: 0.4460 g / [(508.9 + 16.0 x) g·mol-1 La2Ca2MnO6+x中,锰的价态为: [2 ×(6+x) -2 ×3 -2×2 = (2+2x) 溶样过程中锰的价态变化为: (2+2 x- 2) =' 2' x 锰得电子数与C2O42-给电子数相等: 2 x× 0.4460 g / [(508.9 + 16.0 x) g·mol-1 =' 2' ×0.8468 ´ 10-3 mol x =' 1.012' ≈1 (2)尝试法 因为溶样过程消耗了相当量的C2O42-,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,相应氧化物的化学式为La2Ca2MnO6.5, 此化学式式量为516.9 g·mol-1, 称取样品的物质的量为: 0.4460 g / (516.9 g·mol-1) =' 8.628' ×10-4 mol 在溶样过程中锰的价态变化为 1.689× 10-3 mol / (8. 628×10-4 mol) =' 1.96' 锰在复合氧化物中的价态为: 2 + 1.96 =' 3.96 ' 3.96与3差别很大,+3价假设不成立; 而结果提示Mn更接近于+4价。 若设Mn为+4价, 相应氧化物的化学式为La2Ca2MnO7, 此化学式式量为524.9 g·mol-1。 锰在复合氧化物中的价态为:2 + 2 × 0.8468 ×10-3 / (0.4460 / 524.9) =' 3.99' ≈ 4 假设与结果吻合,可见在复合氧化物中,Mn为+4价。 该复合氧化物的化学式为La2Ca2MnO7 溶样过程的反应方程式为: La2Ca2MnO7 + C2O42- + 14H+ = 2La3+ + 2Ca2+ + Mn2+ + 2CO2 + 7H2O |
| ⑴此过程为标准溶液的标定,根据关系式5C2O42-~2MnO4-,用C2O42-标准溶液标定出MnO4-的浓度。 ⑵该分析过程属于容量分析的返滴定类型,用KMnO4滴定过量的C2O42-。根据电子得失守恒关系,可列出下式 Mn元素得失电子数+5×n(MnO4-)=2×n(C2O42-) 求得Mn元素得失电子的物质的量为1.694 mmol 设复合氧化物的通式(La2Ca2MnO6+x),求得氧化物中Mn的物质的量,进而求得滴定过程中锰元素氧化数的变化,最终确定氧化物中锰的氧化数。 |
相似问题
(1)配平下列化学方程式S+_____NaOH_____Na2S +_____Na2SO3 +___
(1)配平下列化学方程式S+_____NaOH_____Na2S +_____Na2SO3 +_____H2O (2)指出被氧化的元素是_______,被还原的元素是_______,氧化产物_______
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体 它在潮湿的环境中能发生反应:3 NF3 + 5
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3 NF3 + 5 H2O =" 2" NO + HNO3 + 9 HF。下列有关该反应
已知可用Co2O3代替MnO2制备Cl2 反应前后存在六种微粒:Co2O3 H2O Cl2 H+ C
已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是A.氧化产物为Cl2B.氧化剂与还原剂的物质的
(1)在-50℃时 液氨存在如下电离:2NH3?NH4++NH-2 k=2×10-12 液氨的电离达
(1)在-50℃时,液氨存在如下电离:2NH3?NH4++NH-2,k=2×10-12,液氨的电离达到平衡时,各微粒的浓度大小关系为______,加入NH4Cl固体,K______2×10-1
原剂的物质的量之比为5∶2。则n的值是 A.1B
原剂的物质的量之比为5∶2。则n的值是A.1B.2C.3D.4












