随着材料科学的发展 金属钒及其化合物得到了越来越广泛的应用 并被誉为“合金的维生素”.为回收利用含钒
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
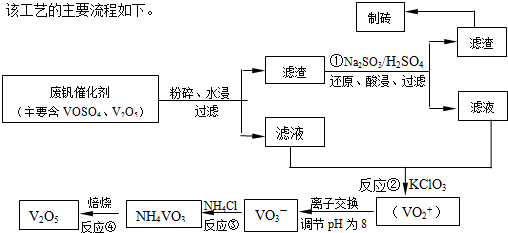 请回答下列问题: (1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为______. (2)反应①的目的是______. (3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式______. (4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式. ______VO2++______H2C2O4+______H+→______VO2++______ CO2+______. (5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变 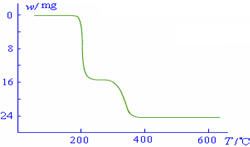 化的曲线如右图所示.则NH4VO3在分解过程中______. A.先分解失去H2O,再分解失去NH3 B.先分解失去NH3,再分解失去H2O C.同时分解失去H2O和NH3 D.同时分解失去H2、N2和H2O. |
参考解答
(1)钒核外电子排布式为1s22s22p63s23p63d34s2,处于d区,故钒处于第四周期第ⅤB族;铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al
故答案为:四;VB;3V2O5+10Al
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5 转化为可溶性的VOSO4,便于提纯, 故答案为:将V2O5 转化为可溶性的VOSO4; (3)根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为:NH4++VO3-=NH4VO3↓, 故答案为:NH4++VO3-=NH4VO3↓; (4)测定反应②溶液中钒的含量,可用已知浓度的酸化H2C2O4溶液滴定(VO2)2SO4溶液,主要产物为CO2和VOSO4,根据化合价升降,写出的离子方程为2VO2++H2C2O4+2H+=2 VO2++2 CO2↑+2 H2O, 故答案为:2;1;2;2;2;2H2O; (5)根据NH4VO3在焙烧变化的图象可知: 2NH4VO3═V2O5+2NH3↑+H2O 234g 34g 18g 减少值开始为0~17g,曲线到200℃时(约为16.0g)曲线开始平直;到约为300℃时又开始减少(H2O的质量),到350℃时减少24g时就不再变化,所以NH4VO3在焙烧过程中200℃时左右先失去氨;在300~350℃再失去水, 故答案为:B. |
相似问题
在一定条件下 PbO2与Cr3+反应 产物是Cr2O72-和Pb2+ 则与1molCr3+反应所需P
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1molCr3+反应所需PbO2的物质的量为……() A.3 0mol B.1 5mol C.1 0mol D.0 75mol
硫氰(SCN)2与卤素X2性质相似 试完成下列反应的化学方程式:HSCN+MnO2_________
硫氰(SCN)2与卤素X2性质相似,试完成下列反应的化学方程式:HSCN+MnO2___________________
(1)配平氧化还原反应方程式:___C2O42-+___MnO4-+___H+=___CO2+___
(1)配平氧化还原反应方程式:___C2O42-+___MnO4-+___H+=___CO2+___Mn2++___H2O (2)称取6 0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成2
近年来 我国储氢纳米碳管研究获重大进展 电弧法合成的碳纳米管 常伴有大量杂质--碳纳米颗粒。这种碳纳
近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量杂质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体 可溶于水 在中性或酸性溶液中逐渐分解 在碱性溶液中稳
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.方法Ⅰ:次












