(14分)下表为元素周期表的一部分:族周期 1① 2 ② 3③ ④ ⑤⑥
(14分)下表为元素周期表的一部分:
(1)写出元素④在周期表中的位置: ; (2)②③⑤的原子半径由大到小的顺序为 ; (3)④⑤⑥的气态氢化物的稳定性由强到弱的顺序是 ; (4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化 合物的电子式: 。 Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一 种淡黄色固体。则: 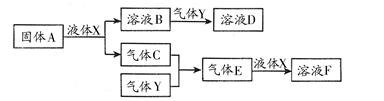 (1)写出固体A与液体X反应的离子方程式: ; (2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1∶1且恰好完全反应时,所得溶液D的溶质为 (填化学式);已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 ; (3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积(标况下)可能为: 。 A.40.32 L B.30.24 L C.20.16 L D.13.44 L | ||||||||||||||||||||||||||||||||||||
参考解答
| (14分) Ⅰ.⑴第三周期ⅣA族;(1分) ⑵ Na>S>O ;(2分) ⑶ HCl>H2S>SiH4 ;(2分) ⑷ Na+ 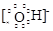 、 、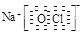 ;(2分) ;(2分)Ⅱ.⑴ 2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑;(2分) ⑵ NaHSO3;(1分) c(Na+)>c(HSO 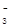 )>c(H+)>c(SO )>c(H+)>c(SO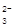 )>c(OH-) ;(2分) )>c(OH-) ;(2分)⑶ D 。(2分) |
试题分析:Ⅰ.根据元素周期表的结构判断①②③④⑤⑥分别是H、O、Na、Si、S、Cl元素。 (1)元素④Si在周期表中的位置是第三周期ⅣA族; (2)②③⑤的原子半径由大到小的顺序为Na、S在第三周期,O在第二周期,Na在S的右侧,所以原子半径:Na>S>O; (3)④⑤⑥元素的非金属性强弱顺序是Si<S<Cl,所以气态氢化物的稳定性由强到弱的顺序是HCl>H2S>SiH4; (4)①②③⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO、NaClO3等,电子式为Na+ 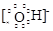 、 、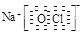 ; ;Ⅱ.(1)A是一种淡黄色固体,由A能与某种液体反应,说明A是过氧化钠,该液体是水,二者反应的化学方程式为2Na2O2 + 2H2O = 4Na+ + 4OH-+ O2↑; (2)溶液B是氢氧化钠溶液,气体C是氧气,气体Y是一种大气污染物,直接排放会形成酸雨。说明气体Y是二氧化硫。二氧化硫与氢氧化钠1:1完全反应时的产物根据元素守恒法可判断为NaHSO3;NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解程度,所以溶液中的离子浓度的大小关系是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-); (3)F为硫酸,100 mL 18 mol/L的硫酸浓溶液中硫酸的物质的量是1.8mol,浓硫酸与Cu完全反应,最多生成0.9mol的二氧化硫,但随着反应的进行,硫酸浓度变稀,Cu不与稀硫酸反应,所以产生的二氧化硫的物质的量小于0.9mol,体积(标准状况)则小于20.16L,所以答案选D。 |
相似问题
元素周期表中某区域的一些元素多用于制造半导体材料 它们是( ) A.左 下方区域的金属元素
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A.左、下方区域的金属元素B.金属元素和非金属元素分界线附近的元素C.右、上方区域的非
下列叙述中 金属a的活泼性肯定比金属b的活泼性强的是 ( ) A.a原子的最外层电子数比
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是 ( )A.a原子的最外层电子数比B原子的最外层电子数少B.a原子电子层数比b原子的电子层数多C.1mol
短周期主族元素W X Y Z位于同一周期 且原子序数依次增大。W X是金属元素 Y Z是非金属元素
短周期主族元素W、X、Y、Z位于同一周期,且原子序数依次增大。W、X是金属元素,Y、Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应,Y的最外
下列叙述中正确的是( )A.除零族元素外 短周期元素的最高化合价在数值上都等于该元素所属
下列叙述中正确的是( )A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.除短周期外,其他周期均有18种元素C.副族元素中没有
已知X Y Z W四种短周期主族元素在周期表中相对位置如图所示 下列说法不正确的是XYZW A.Y原
已知X、Y、Z、W四种短周期主族元素在周期表中相对位置如图所示,下列说法不正确的是XYZWA.Y原子形成的简单离子半径一定比X原子形成的简单离子半径小B.W


 族
族









