(15分)开发新型储氢材料是氢能利用的重要研究方向。(1)化合物A(H3BNH3)是一种潜在的储氢材
| (15分)开发新型储氢材料是氢能利用的重要研究方向。 (1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答: ①H3BNH3中是否存在配位键 (填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为 ,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为 。 ②与(HB=NH)3互为等电子体的分子为 (填分子式) ③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为 。 ④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为 ,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为 。 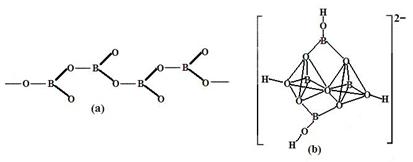 (2)一种铜合金具有储氢功能 ①Cu2+的价层电子排布式为 。 ②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是 。 ③铜的单质中按ABCABC……方式堆积,设铜原子半径为a pm,则该晶体的密度为 g/cm3(阿伏伽德罗常数值为NA) |
参考解答
| (1)①是,N>O>C>B CO2>CH4>H2O;②C6H6 ;③4BCl3+3LiAlH4=2B2H6+3LiCl+3AlCl3 (或4BCl3+3LiAlH4=2B2H6+3LiAlCl4)④BO2--;sp3、sp2;(2)①3d9;②激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长的光的形式释放能量;③ 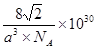 。 。 |
试题分析:(1)①在H3BNH3中的B与N原子之间存在配位键;B、C、N、O是同一周期的元素。一般情况下,元素的非金属性越强,原子半径越小,元素的第一电离能既有越大,但是由于N原子的2p轨道上的电子处于半充满的稳定状态,所以其电离能比O还大。因此第一电离能由大到小的顺序N>O>C>B;CH4是正四面体结构,键角109°28′;H2O是V型分子,键角104.3°,CO2是直线型分子,键角为180°。因此这三分子按照键角由大到小的顺序排列为CO2>CH4>H2O;②等电子体是原子数等,最外层电子数也相等的物质。与(HB=NH)3互为等电子体的分子为C6H6 ;③根据题意可得合成乙硼烷B2H6,的化学方程式为4BCl3+3LiAlH4=2B2H6+3LiCl+3AlCl3;也可写作4BCl3+3LiAlH4=2B2H6+3LiAlCl4。④多硼酸根的化学式为BO2--;在图b硼原子采取的杂化方式为sp3、sp2;(2)①Cu是29号元素,Cu2+的价层电子排布式为3d9;②铜及其它许多金属及其化合物都可以发生焰色反应的原因是在灼烧时原子中的电子吸收能量,从基态跃迁到激发态。但是激发态是不稳定的,激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长的光的形式释放能量;③Cu是面心立方紧密堆积,在一个晶胞中含有的Cu原子的个数为:8×1/8+6×1/2='4;' 设铜原子半径为a pm.晶胞的边长L. 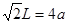 ;L=2 ;L=2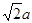 ;该晶体的密度为 ;该晶体的密度为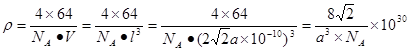 g/cm3. g/cm3. |
相似问题
下列叙述中 正确的是A.在一个基态多电子的原子中 可以有两个运动状态完全相同的电子B.在一个基态多电
下列叙述中,正确的是A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子C.
处于同一周期的A B C D四种短周期元素 其气态原子获得一个电子所放出的能量A>B>C>D。则下列
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是A.元素的非
关于12C 14C 13N 14N几种原子的相互关系描述正确的是A.14C和14N质量数相同 互为同
关于12C、14C、13N、14N几种原子的相互关系描述正确的是A.14C和14N质量数相同,互为同位素B.12C和14N含有相同的中子数C.12C和 13N中子数相同,质子数
(15分)已知A B C D E都是周期表中前四周期的元素 它们的核电荷数依次增加。相关信息如下表所
(15分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用
右表为元素周期表前四周期的一部分 下列有关W X Y Z R五种元素的叙述中 正确的是( )A.
右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是()A.常温下,Z单质为气态物质B.Y、Z的阴离子电子层结构都与R原












