金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:(1)Ni原子的核外电子排布式为
| 金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题: (1)Ni原子的核外电子排布式为______________________________; (2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”); (3)NiO晶胞中Ni和O的配位数分别为_______________、_______________; (4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________; 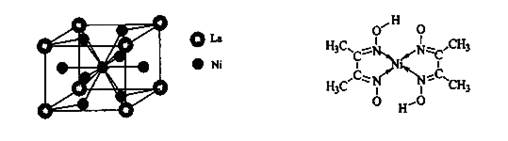 (5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。 ①该结构中,碳碳之间的共价键类型是 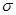 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________; 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;②该结构中,氧氢之间除共价键外还可存在_______________; ③该结构中,碳原子的杂化轨道类型有_______________。 |
参考解答
| (1) 1s22s22p63s23p63d84s2 (2)> (3)6 6 (4) LaNi5 (5) ①一个σ键、一个π键;配位键;②氢键;③sp2、sp3 |
(1)利用能量最低原理等可知28Ni的核外电子排布式为:1s22s22p63s23p63d84s2。(2)利用Ni2+与Fe2+的离子半径大小关系可知NiO的晶格能大于FeO的,故熔点:NiO>FeO。(3)利用信息知可类比NaCl的配位数可知NiO晶胞中Ni与O的配位数均为6。(4)由“均摊法”知每个晶胞中含有:一个La(8×1/8)、五个Ni(1+8×1/2),故该合金的化学式为:LaNi5。(5)①在该结构中,碳氮双键中其中一个是σ键、一个是π键;氮镍之间的键是由N原子提供孤对电子,Ni提供空轨道形成的配位键。②由于氧的电负性强,因此该结构中,氧氢之间除形成共价键外,还可以形成氢键。③该结构中-CH3中的碳原子是sp3杂化、用于形成C=N的碳原子是sp2杂化。 |
相似问题
下列结论正确的是( )①粒子半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl
下列结论正确的是()①粒子半径:K+>Al3+>S2->Cl-②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I-④氧化性:C
下列递变情况中不正确的是A.HF HCl HBr HI的沸点依次升高B.硅 磷 硫 氯元素的最高正化
下列递变情况中不正确的是A.HF、HCl、HBr、HI的沸点依次升高B.硅、磷、硫、氯元素的最高正化合价依次升高C.O2-、F-、Na+、Mg2+的离子半径依次增大D.
根据元素周期表1~20号元素的性质和递变规律 回答下列问题。(1)属于金属元素的有____种 金属性
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。(1)属于金属元素的有____种,金属性最强的元素与氧气反应生成的化合物有______________(
M X Y Z是四种常见的短周期元素 各元素在周期表中的位置如图所示 其中只有M属于金属元素。下列说
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是A.Y元素气态氢化物的稳定性大于Z元
(15分) M N O P Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层
(15分) M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸












