(15分) M N O P Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层
| (15分) M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题: (1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。 (2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________. (3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。 (4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。 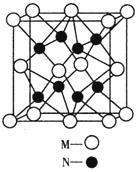 (5)该晶胞的边长为a×10 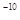 cm,则距离最近的M、N离子间的距离为 cm,则距离最近的M、N离子间的距离为__________cm。 |
参考解答
| (1)锰(1分) 3d54s1(2分) (2)HF分子间存在氢键,而HCl分子间无氢键(2分) (3)O>Cl(1分) 正四面体形(1分) sp3杂化(1分) (4)Na2O(2分) 8(1分) 离子晶体(1分) (5) 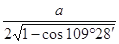 ×10-10或 ×10-10或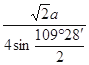 ×10-10或 ×10-10或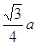 ×10-10(3分,或其他合理答案) ×10-10(3分,或其他合理答案) |
试题分析:依题意可知:M为氧元素,N为钠元素,O是氯元素,P是铬元素,Q是锰元素,因此有: (1)元素Q的名称为锰,P的基态原子价层电子排布式为3d54s1; (2)O的氢化物的沸点比其上一周期同族元素的氢化物低是因为HF分子间存在氢键,而HCl分子间无氢键 (3)M、O电负性大小顺序是O>Cl,O的最高价含氧酸根为ClO4-,空间构型为正四面体。空间构型其中心原子的杂化类型为sp3杂化 (4)M微粒的数目为: 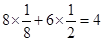 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。 ;N微粒的数目为:8;因此M、N形成的化合物的晶胞的化学式为Na2O;其中M离子的配位数为8,该晶体类型为离子晶体。(5) 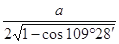 ×10-10或 ×10-10或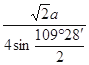 ×10-10或 ×10-10或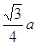 ×10-10 ×10-10 |
相似问题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3; ③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是A.第一电离
W X Y Z是短周期元素 其部分性质如表 下列说法正确的是W单质是淡黄色固体X在地壳中的含量居第二
W、X、Y、Z是短周期元素,其部分性质如表,下列说法正确的是W单质是淡黄色固体X在地壳中的含量居第二位Y原子最外层电子数是电子总数的2 3Z第三周期原子半
月球土壤中吸附着数百万吨的He 每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于
月球土壤中吸附着数百万吨的He,每百吨He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于He的说法正确的是A.He原子核内含有2个中子B.He原
下列叙述中正确的是A.卤素单质与水反应均可用X2+H2O===HXO+HX表示B.从F2到I2 卤素
下列叙述中正确的是A.卤素单质与水反应均可用X2+H2O===HXO+HX表示B.从F2到I2,卤素单质的颜色随着相对分子质量的增大而加深C.熔、沸点:Li>Na>KD.
下列递变规律不正确的是 ( )A:Na Mg Al还原性依次减弱 B:C N O原子半径依次
下列递变规律不正确的是()A:Na、Mg、Al还原性依次减弱 B:C、N、O原子半径依次增大C:P、S、Cl最高正价依次升高 D:I2、Br2、Cl2氧化性依次增强












