(15分)X Y Z W R T为前四周期元素且原子序数依次增大。T原子序数等于X Y R原子序数之
(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2 X+2WZ X+2WZ回答下列问题: (1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。 (2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。 (3)由X、T元素组成的单质中一定不存在 (填序号)。
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。① [T(NH3)n]+中n= 。② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。 (6)化合物WZ和NaCl的晶胞结构形似 (氯化钠晶胞结构如右图所示)。 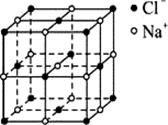 ①在WZ中,阳离子和阴离子的配位数均为 。 ②已知WZ的密度为a g/cm3,则WZ中距离最近的阳离子间的距离为 pm(用含a的算式表示,阿伏伽德罗常数为NA)。 |
参考解答
| (1)N (2)SO3,SP2 (3)A (4)1S22S22P63S23P63d104S1或[Ar 3d104S1 (5)2,直线 (6)6, 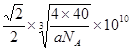 |
| 试题分析:(1)根据题意可知这几种元素分别是:X是C;Y是 N;Z是O;W是Mg ;R是S;T是Cu。(1)C、N、O是同一周期的元素,一般情况下,元素的非金属性越强,原子半径越小,其第一电离能越大。但是由于N原子是最外层的2p轨道上的电子处于半充满的稳定状态,所以N的第一电离能比O还大。因此第一电离能最大的是N;(2)O、S两种元素可以形成SO2、SO3两种化合物,属于非极性分子的是SO3,其中S原子的杂化方式是SP2;(3)C元素的单质有金刚石、石墨、C60; 金刚石、石墨是原子晶体,C60是分子晶体;Cu形成的是金属,属于金属晶体。因此不存在的晶体类型是离子晶体。选项为A。(4)基态Cu原子的核外电子排布式为1S22S22P63S23P63d104S1或[Ar 3d104S1;(5)① [CuNH3)n+中n=2,② 在[Cu(NH3)n+中Cu+与2个氮原子构成的空间结构呈直线型。(6)①在MgO中,每个Mg2+离子周围有6个O2-,每个O2-离子的周围有6个Mg2+,所以它们的配位数均为6;②在每个晶胞中含有的Mg2+离子是:12×1/4+1=4;含有的O2-离子是:8×1/8+6×1/2=4.因此每个晶胞中含有4个MgO。假设晶胞的的边长为L,则由晶胞结构示意图可知,两个最近的阳离子间的距离为 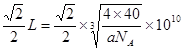 。 。 |
相似问题
[物质结构与性质]含有NaOH的Cu(OH)2悬浊液可用于检验醛基 也可用于和葡萄糖反应制备纳米Cu
[物质结构与性质]含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。(1)Cu+基态核外电子排布式为(2)与OH-互为等电子体的
J Q M R T是原子序数依次增大的短周期主族元素 J Q R在周期表中的相对位置如下表。已知J元
J、Q、M、R、T是原子序数依次增大的短周期主族元素,J、Q、R在周期表中的相对位置如下表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等;M是
元素R有如下反应:RO+5R-+6H+===3R2+3H2O 下列说法正确的是( )A.元素R位
元素R有如下反应:RO+5R-+6H+===3R2+3H2O,下列说法正确的是()A.元素R位于周期表中第ⅤA族B.RO中的R只能被还原 C.每反应消耗1 mol RO,转移
已知aAn+ bB(n+1)+ cCn- dD(n+1)-具有相同的电子层结构 关于A B C D四
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是A.这四种离子的电子层结构相同,因而离子的性质也就
下列元素中基态原子的第一电离能最大的是( )A.BB.CC.ND.O
下列元素中基态原子的第一电离能最大的是( )A.BB.CC.ND.O












