(15分)现有A B C D E F G H八种短周期主族元素 原子序数依次增大。已知A与E D与G
| (15分)现有A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。已知A与E、D与G分别同主族;E、F、G、H同周期;A分别与C、D可形成含有10个电子的共价化合物M、N;B的最外层电子数是其电子层数的2倍;D是地壳中含量最多的元素;F位于B的前一主族。请回答下列问题: (1)元素B在周期表中的位置 ,M的空间构型是 。 (2)A、D、E三种元素组成一种常见化合物,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W的电子式为 ,工业上利用某一个反应可同时生产该化合物和H的单质,写出该反应的化学方程式 。 (3)E、F元素的最高价氧化物对应的水化物之间反应的离子方程式 。 (4)M、N均能结合H+,其中结合H+能力较强的是 (填化学式)。N结合H+所形成的微粒中心原子采用 杂化。其键角比N中的键角大,原因为 。 (5)E分别与D、G形成摩尔质量相等的化合物X、Y,其中Y的水溶液显碱性的原因是 (用离子方程式表示)。常温下7.8 g X与水反应放出Q kJ热量(Q>0),写出该反应的热化学方程式 。 |
参考解答
| (1)第2周期ⅣA族; 三角锥形; (2) 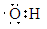 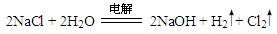 (3)Al(OH)3 + OH-==AlO2- + 2H2O (4)NH3;sp3;H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小 (5)S2-+ H2O  HS- + OH- ; HS- + OH- ; 2Na2O2(s) + 2H2O(1)='=4NaOH(aq)' + O2(g) △H=-20Q kJ/mol |
试题分析:根据题意知,A、B、C、D、E、F、G、H八种短周期主族元素,原子序数依次增大。B的最外层电子数是其电子层数的2倍,则B为碳元素;D是地壳中含量最多的元素,则D为氧元素,C为氮元素;A分别与C、D可形成含有10个电子的共价化合物M、N,则A为氢元素,M为NH3,N为H2O;D与G分别同主族,则G为硫元素,H为氯元素;A与E同主族,则E为钠元素;F位于B的前一主族,则F为铝元素。(1)元素B为碳元素,在周期表中的位置第2周期ⅣA族;M为NH3,空间构型是三角锥形;(2)A、D、E三种元素组成一种常见化合物氢氧化钠,W与该化合物的阴离子具有相同的原子种类和数目且不带电,W为羟基,电子式见答案;工业上电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,化学方程式为2NaCl+2H2O 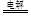 2NaOH+H2↑+Cl2↑。(3)氢氧化钠和氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3 + OH-==AlO2- + 2H2O;(4)NH3和H2O均能结合H+,其中结合H+能力较强的是NH3;H3O+中心原子采用sp3杂化,其键角比H2O中的键角大,原因为H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小;(5)硫化钠的水溶液显碱性的原因是S2-+ H2O 2NaOH+H2↑+Cl2↑。(3)氢氧化钠和氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3 + OH-==AlO2- + 2H2O;(4)NH3和H2O均能结合H+,其中结合H+能力较强的是NH3;H3O+中心原子采用sp3杂化,其键角比H2O中的键角大,原因为H2O中O原子有2对孤对电子,H3O+中O原子有1对孤对电子,排斥力小;(5)硫化钠的水溶液显碱性的原因是S2-+ H2O HS- + OH- ;常温下7.8 g X与水反应放出Q kJ热量(Q>0),该反应的热化学方程式为2Na2O2(s) + 2H2O(1)='=4NaOH(aq)' + O2(g) △H=-20Q kJ/mol。 HS- + OH- ;常温下7.8 g X与水反应放出Q kJ热量(Q>0),该反应的热化学方程式为2Na2O2(s) + 2H2O(1)='=4NaOH(aq)' + O2(g) △H=-20Q kJ/mol。 |
相似问题
关于下列各组物质的相互关系 判断正确的是( )A.互为同素异形体的是①②B.互为同位素的是②③C
关于下列各组物质的相互关系,判断正确的是()A.互为同素异形体的是①②B.互为同位素的是②③C.互为同一物质的是①⑤D.互为同分异构体的是④⑤
下列叙述中错误的是 ( )A.原子半径:Cl>S>OB.还原性:Na>Mg>AlC.稳定性:HF
下列叙述中错误的是 ()A.原子半径:Cl>S>OB.还原性:Na>Mg>AlC.稳定性:HF>HCl>HBrD.酸性:HClO4>H2SO4>H3PO4
四种短周期元素在周期表中的位置如图 其中只有M为金属元素。下列说法不正确的是 YZMX A.原子半径
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是YZMXA.原子半径Z<MB.Y的最高价氧化物对应水化物的酸性比X 的弱C.X
核电荷数小于l8的某元素X 其原子的电子层数为n 最外层电子数为(2n+1) 原子核内质子数为(2n
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n2-1)。下列关于元素X的说法中,不正确的是A.其最高化合价
(14分)现有X Y Z W R五种元素 其中前四种为短周期主族元素。X原子的最外层电子数是核外电子
(14分)现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同












