(14分)现有X Y Z W R五种元素 其中前四种为短周期主族元素。X原子的最外层电子数是核外电子
| (14分)现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5。 (1)R元素在周期表中的位置 ;W2X2的电子式 。 (2)X、Y、Z的最低价氢化物中:沸点最高的是 (填化学式);共价键键能最小的是 ;X、Y、Z的杂化类型 (填相同或不相同)。 (3)若R的晶体中每个晶胞平均含有2个R原子,请在下图晶胞中用?标出未画出的R原子。 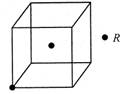 (4)将1.19g ZXY2溶于100ml水中发生非氧化还原反应,生成2种酸,反应方程式为 ;所得溶液中阴离子浓度由大到小的顺序是 。 |
参考解答
| (14分) (1)第四周期VIIB (2分) (2)H2O(1分) H2S(1分) 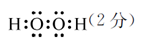 相同(2分) 相同(2分)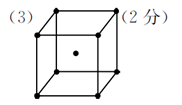 (4)SOCl2+2H2O=2HCl+H2SO3(2分) c(Cl ̄) > c(HSO3 ̄) > c(SO32 ̄) > c(OH ̄) (2分) |
试题分析:X原子的最外层电子数是核外电子层数的3倍,则X为O元素;X、Z同主族,且为短周期元素,则Z为S元素;Y的最高正价与最低负价的代数和为6,则Y为Cl元素;W与X、Y均不同周期,W为H元素;R2+的价电子排布式为3d5,故R为Mn元素。 (1)R为Mn元素,原子序数为25,在周期表中位于第四周期VIIB;W2X2为H2O2电子式为: 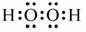 (2)X、Y、Z的最低价氢化物分别为H2O、HCl、H2S,因为H2O分子间能形成氢键,作用力更强,所以H2O的沸点最高;O、Cl、S元素非金属性最弱的是S元素,所以H2S共价键键能最小;O、Cl、S的杂化类型都是sp3杂化,杂化类型相同。 (3)每个晶胞平均含有2个R原子,图中已标出的原子位于体心,则未标出的R原子应在立方体的8个顶点上。 (4)ZXY2为SOCl2与水发生非氧化还原反应,生成2种酸为HCl和H2SO3,所以化学方程式为:SOCl2+2H2O=2HCl+H2SO3;H2SO3为中强酸,第一步电离大于第二步电离,所以阴离子浓度由大到小的顺序是:c(Cl ̄) > c(HSO3 ̄) > c(SO32 ̄) > c(OH ̄) |
相似问题
有a b c d四种金属 将a与b用导线连结起来浸入稀硫酸溶液中 b不被腐蚀。将a d分别投入等浓度
有a、b、c、d四种金属,将a与b用导线连结起来浸入稀硫酸溶液中,b不被腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显
据报道 某些建筑材料会产生放射性同位素氡 从而对人体产生危害。该同位素原子的中子数和质子数之差为
据报道,某些建筑材料会产生放射性同位素氡,从而对人体产生危害。该同位素原子的中子数和质子数之差为A.136B.50C.86D.222
是常规核裂变产物之一 可以通过测定大气或水中的含量变化来检测核电站是否发生放射性物质泄漏。下列有关的
是常规核裂变产物之一,可以通过测定大气或水中的含量变化来检测核电站是否发生放射性物质泄漏。下列有关的叙述中错误的是( )A.的化学性质与相同B.的
下表是元素周期表的一部分 X Y Z W均为短周期元素 下列说法不正确的是( ) X YZ W
下表是元素周期表的一部分,X、Y、Z、W均为短周期元素,下列说法不正确的是()XYZWA.原子半径:Z>W>XB.若Z的最高价氧化物与Y的气态氢化物溶液混合后有
元素R X T Z Q在元素周期表中的相对位置如下表所示 其中R单质在暗处与H2剧烈化合并发生爆炸
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )A.非金属性:Z<T<XB.R与Q的












