七水硫酸镁(MgSO4?7H2O)在印染 造纸和医药等工业上都有广泛的应用 利用化工厂生产硼砂的废渣
| 七水硫酸镁(MgSO4?7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等). 表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
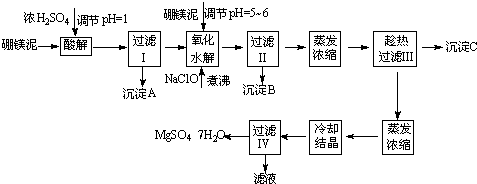 根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题: (1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为______.加热煮沸的主要目的是______. (2)沉淀B中除MnO2、SiO2外还含有______(填化学式)等物质. (3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是______; (4)沉淀C的化学式是______.过滤Ⅲ需趁热过滤的理由是______. |
参考解答
| (1)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解 以及Mn2+氧化成MnO2,故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;促进Al3+、Fe3+水解及Mn2+氧化成MnO2; (2)根据表中数据可知,在调节溶液的PH在5~6时,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3; (3)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色, 证明滤液中无Fe3+; (4)CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出, 故答案为:CaSO4?2H2O或CaSO4;以防MgSO4在温度低时结晶析出. |
相似问题
已知电离平衡常数:H2CO3>HClO>HCO3- 氧化性:HClO>Cl2>Br2>Fe3+>I2
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 [ ]A.能使pH试纸显深红色的溶
氰(CN)2 硫氰(SCN)2的化学性质和卤素很相似 化学上称为“类卤素” 它们阴离子的还原性强弱为
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.试写出:(1)(CN)2与K
能用H++OH-═H2O来表示的化学反应是( )A.CuO溶于稀H2SO4B.澄清石灰水和HNO3
能用H++OH-═H2O来表示的化学反应是( )A.CuO溶于稀H2SO4B.澄清石灰水和HNO3溶液反应C.KOH溶液和醋酸酸溶液反应D.Ba(OH)2溶液和H2SO4溶液反应
Ⅰ.某学生设计了用新制氯水 KSCN溶液 0.1mol?L-1FeCl2溶液探究Fe2+和Fe3+的
Ⅰ.某学生设计了用新制氯水、KSCN溶液、0 1mol?L-1FeCl2溶液探究Fe2+和Fe3+的转化条件实验.操作为:取少量久置的FeCl2溶液,滴加KSCN溶液,再滴入氯水
下列离子方程式书写正确的是 [ ]A.将Na2O2加入H2O中:Na2O2+H2O=2Na
下列离子方程式书写正确的是[ ]A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4N












