Ⅰ.某学生设计了用新制氯水 KSCN溶液 0.1mol?L-1FeCl2溶液探究Fe2+和Fe3+的
| Ⅰ.某学生设计了用新制氯水、KSCN溶液、0.1mol?L-1FeCl2溶液探究Fe2+和Fe3+的转化条件实验.操作为:取少量久置的FeCl2溶液,滴加KSCN溶液,再滴入氯水. (1)写出该实验发生的离子反应方程式______; (2)实际操作中出现了异常现象,FeCl2溶液滴入KSCN后就出现了浅红色,请分析最可能的原因______; (3)由上述异常现象该同学联想到用KI淀粉溶液检验食用盐中IO3-的实验,检验原理是:IO3-+5I-+6H+=3I2+3H2O.为此进行了一系列探究实验如下:
(4)经讨论,将KI换成其他试剂重新设计方案并取得了成功.你认为代替KI的可以是______ A.Na2SO3 B.Vc C.FeSO4 D.FeCl3 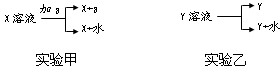 Ⅱ.从X、Y两种溶液中分离固体X、Y的方法为 (1)实验甲中a应具有的性质为______; (2)实验乙一般在______条件下实现,并借助下图中______装置分离出Y.  |
参考解答
| Ⅰ(1)氯气有强氧化性,二价铁离子有还原性,所以氯气能氧化二价铁离子生成三价铁离子;三价铁离子能和硫氰化钾溶液发生络合反应, 故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3 ; (2)二价铁离子能被空气中的氧气氧化生成三价铁离子,故答案为:Fe2+被空气中的氧气氧化了; (3)该反应必须在酸性条件下反应,加入碘化钾溶液后充分振荡,碘离子被氧气氧化成碘单质,4I-+O2+4H+=2I2+2H2O, 故答案为:滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡;4I-+O2+4H+=2I2+2H2O; (4)碘化钾和碘酸钾的反应中碘化钾作还原剂,所以只要是具有还原性的物质就可代替碘化钾,亚硫酸根离子、Vc和二价铁离子都具有还原性,所以可以代替碘化钾, 故答案为:ABC; Ⅱ(1)从实验甲知,该实验是把溶质从一种溶剂转移到另一种溶剂中,应采取采取的方法,所以a是萃取剂,萃取剂必须易溶解X不溶于水,不与X也不与水反应, 故答案为:易溶解X不溶于水不与X也不与水反应; (2)过实验乙知,该实验是从溶剂中析出部分溶质,采用较少溶剂或降低溶解度的方法,所以应在降低温度或蒸发溶剂条件下实现;固体和液体分离采取过滤的方法, 故答案为:降温或蒸发;A. |
相似问题
下列离子方程式书写正确的是 [ ]A.将Na2O2加入H2O中:Na2O2+H2O=2Na
下列离子方程式书写正确的是[ ]A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4N
下列离子方程式正确的是( )A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
下列离子方程式正确的是( )A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2OB.碳酸氢钙溶液跟稀硝酸反应Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑C.
下列离子方程式正确的是( )A.石灰石与稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2
下列离子方程式正确的是( )A.石灰石与稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2OB.钠与水反应:Na+H2O═Na++OH-+H2↑C.氨水跟稀Mg(NO3)2溶液
含有amol FeBr2的溶液中 通入xmol Cl2.下列各项为通Cl2过程中 溶液内发生反应的离
含有amol FeBr2的溶液中,通入xmolCl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )A.x=0 4a,2Fe2++Cl2=2Fe3++2Cl-B
下列属于正确的水解离子方程式的是( )A.NH4++H2ONH3?H2O+H+B.H2O+H2OH
下列属于正确的水解离子方程式的是( )A.NH4++H2ONH3?H2O+H+B.H2O+H2OH3O++OH-C.CO32-+2H2OH2CO3+2OH-D.Fe3++3H2OFe(OH)3↓+3H+












