在一条鱼 虾绝迹的小河边有四座工厂:甲 乙 丙 丁(如图所示) 它们排出的废液里 每个工厂只含有Na
| 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.请判断: (1)四座工厂排出的废液里含有的污染物: 甲______,乙______, 丙______,丁______. (2)写出乙、丁两处发生反应的离子方程式:乙______.丁______. 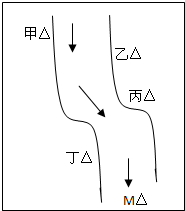 |
参考解答
| 由甲处河水呈乳白色,我们可得在甲处应含有Ca(OH)2; 乙处河水呈红褐色,我们可知乙在甲处的下方且乙排放出的是FeCl3; 丙处河水由浑变清,我们可得丙处在甲乙的下方且丙处排放出的是HCl; 丁处产生气泡,河水仍清,说明丁在丙的下方且含有碳酸钠; M在工厂的下方,所以M处的河水中肯定含有的离子有:Na+、Cl-、Ca2+, 故答案为:Ca(OH)2;FeCl3;HCl;Na2CO3; (2)在乙处,是氯化铁和氢氧化钙之间的反应,实质是:Fe3++3OH-=Fe(OH)3,在丁处,是盐酸和碳酸钠之间的反应,实质是:CO32-+2H+═CO2↑+H2O, 故答案为:Fe3++3OH-=Fe(OH)3;CO32-+2H+═CO2↑+H2O. |
相似问题
在一定体积pH=12的Ba(OH)2溶液中 逐滴加入一定物质的量浓度的NaHSO4溶液 当溶液中的B
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)
(一)写出有关反应的离子方程式:(1)硫酸氢钠溶液与碳酸氢钠溶液的反应______;
(一)写出有关反应的离子方程式:(1)硫酸氢钠溶液与碳酸氢钠溶液的反应______;(2)硫化亚铁投入稀硫酸中反应______;(3)向Na2CO3溶液中加入少量稀
下表中评价合理的是( )选项化学反应及其离子方程式评价AFe3O4与稀硝酸反应:2Fe3O4+18
下表中评价合理的是( )选项化学反应及其离子方程式评价AFe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O正确B向碳酸镁中加入稀盐酸:CO2-3+2H+=CO2
已知固体A的焰色反应呈黄色 D G常温下呈气态 化合物E为淡黄色固体粉末 A B C D E F G
已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:回答下列问题:(1)写出下列物质的化学
下列离子方程式书写正确的是( )A.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH
下列离子方程式书写正确的是( )A.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓B.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑C.钠和冷水反












