化学----化学与技术模块海水中溴元素以Br-形式存在 工业上用空气吹出法从海水中提取溴的工艺流程如
| 化学----化学与技术模块 海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: 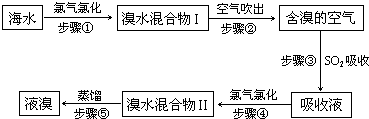 (1)步骤①反应的离子方程式是______. (2)步骤③反应的化学方程式是______. (3)Br的原子序数是______,在周期表中位于______周期______族. (4)步骤⑤蒸馏的过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因:______. (5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?______. |
参考解答
| (1)氧化性氯气比溴强,溴离子容易被氯气氧化为溴的单质,反应为:2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2; (2)溴单质有氧化性,二氧化硫具有还原性,二者之间的反应为:SO2+Br2+2H2O=2HBr+H2SO4,故答案为:SO2+Br2+2H2O=2HBr+H2SO4; (3)溴元素在周期表中和氯元素同主族,位于氯元素的下面,本族的三、四周期元素的原子序数相差18,氯的原子序数为17,则溴为35,在第四周期第ⅤⅡA族,故答案为:35、4、ⅤⅡA; (4)溴的沸点是58.5°C,温度应控制在80~90℃最佳,温度控制过高,水会沸腾,溴蒸气中有水,温度过低,溴蒸气不易挥发,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低; (5)溴水混合物I的组成有水、液溴还有含有氯离子的盐等成分,要获得溴,应采用分馏操作,给实验带来很多麻烦,故答案为:溴水混合物I成分复杂,要获得溴需控制多个温度,操作麻烦. |
相似问题
我国有丰富的海水资源 开发和利用海水资源是当前科学研究的一项重要任务.(1)海水中所含元素质量最大的
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务.(1)海水中所含元素质量最大的是______(写元素符号),被称作海洋元素的是__
(1)NaHSO4在溶液中的电离方程式为:______;(2)向NaHSO4溶液中滴入Ba(OH)2
(1)NaHSO4在溶液中的电离方程式为:______;(2)向NaHSO4溶液中滴入Ba(OH)2溶液至中性,其离子方程式为______;(3)向NaHCO3溶液中滴加过量的Ba(O
下列离子方程式表示正确的是( )A.AgNO3溶液中加入Cu:Cu+Ag+=Cu2++AgB.Fe
下列离子方程式表示正确的是( )A.AgNO3溶液中加入Cu:Cu+Ag+=Cu2++AgB.FeCl2溶液中滴加NaClO溶液生成红褐色沉淀:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C
下列各组物质之间的反应 调节反应物用量 离子方程式不变的是( )A.稀硝酸和FeB.FeBr2溶液
下列各组物质之间的反应,调节反应物用量,离子方程式不变的是( )A.稀硝酸和FeB.FeBr2溶液和Cl2C.AlCl3溶液和NH3?H2OD.NaHCO3溶液和石灰水
已知电离平衡常数:H2CO3>HClO>HCO3- 氧化性:HClO>Cl2>Br2>Fe3+>I2
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )A.能使pH试纸显深












