将0.01 mol下列物质分别加入100 mL蒸馏水中 恢复至室温 所得溶液中阴离子浓度的大小顺序是
| 将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ①Na2O2 ②Na2O ③Na2CO3 ④NaCl
|
参考解答
| C |
0.01 mol Na2O2、Na2O与水反应的方程式分别为Na2O2+H2O=2NaOH+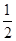 O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O O2↑、Na2O+H2O=2NaOH,二者均产生0.02 mol OH-,因溶液体积变化忽略不计,故所得溶液中阴离子浓度:①=②;Na2CO3和NaCl电离产生的阴离子均为0.01 mol,而CO32—发生微弱的水解:CO+H2O HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。 HCO+OH-,使阴离子数目增多,所得溶液中阴离子浓度:③>④。 |
相似问题
某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数 有关叙述如下。①可以使用MgCl
某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀②检验是否完全沉淀的操
某研究性学习小组在网上收集到信息:钾 钙 钠 镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气
某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:【实
钠露置在空气中 其变质过程中不可能产生的物质是[ ]A.Na2O B.NaOH C.Na
钠露置在空气中,其变质过程中不可能产生的物质是[ ]A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
我国化学家侯德榜改革国外的纯碱生产工艺 生产流程可简要表示如图(1)上述生产纯碱的方法称 副
我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图(1)上述生产纯碱的方法称 ,副产品的一种用途为 。(2)沉淀池中发生的化学
等量的钠分别完全溶于过量的重水(21H2O)与过量的纯水(11H2O)中。下列有关的叙述中 错误的是
等量的钠分别完全溶于过量的重水(21H2O)与过量的纯水(11H2O)中。下列有关的叙述中,错误的是[ ]A.反应后放出的气体的质量相等B.反应后放出的气体












