取A B两份物质的量浓度相等的NaOH溶液 体积均为50 mL 分别向其中通入一定量的CO2后 再分
| 取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。 (1)在NaOH溶液中通入一定量的CO2后,溶液中的溶质的组成可能是: ① ;② ;③ ;④ 。 (2)在稀释后的溶液中分别逐滴加入0.1 mol·L-1的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示。 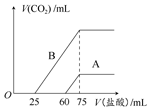 ①分别加入足量的盐酸后,溶液中的溶质是 ,原NaOH溶液的物质的量浓度是 。 ②A曲线表明,通入CO2后,溶液中的溶质是 ,与盐酸反应产生CO2的最大体积是 mL(标准状况)。 ③B曲线表明,原NaOH溶液通入CO2后,所得溶质的化学式为 ,其物质的量之比为 。 |
参考解答
| (1)①Na2CO3和NaOH ②Na2CO3③Na2CO3和NaHCO3④NaHCO3 (2)①NaCl或NaCl和HCl;0.15 mol·L-1②NaOH和Na2CO3;33.6 ③Na2CO3和NaHCO3;1:1。 |
| (1)在NaOH溶液中通入一定量的CO2后,发生的反应有:2NaOH+CO2=Na2CO3+H2O,Na2CO3+H2O+CO2=2NaHCO3(CO2足量)。该反应过程分步进行,故据反应的CO2的量的不同,溶液中的溶质组成可能出现以下几种情况:①Na2CO3和NaOH;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。(2)分析可知,产生气体的反应均为:NaHCO3+HCl=NaCl+H2O+CO2↑,据Na、Cl元素守恒知,c(NaOH)=n(NaOH)/V(NaOH)=n(HCl)/V(NaOH)=(75×10-3L×0.1 mol·L-1)/(50×10-3L)=0.15 mol·L-1。由A曲线及NaHCO3+HCl=NaCl+H2O+CO2↑知,生成的n(CO2)=15×10-3L×0.1 mol·L-1=1.5×10-3 mol(即33.6 mL),即A中刚开始产生气体时n(NaHCO3)=1.5×10-3 mol,产生气体与未产生气体的物质消耗HCl的体积比为1:4,可知A的溶质为NaOH和Na2CO3。结合B曲线知,产生气体与未产生气体的物质消耗HCl的体积比为2:1(Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑),故B中溶质为Na2CO3和NaHCO3,且n(Na2CO3):n(NaHCO3)=1:1。 |
相似问题
NaCl是一种化工原料 可以制备一系列物质(如图)。下列说法正确的是A.25℃ NaHCO3在水中的
NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是A.25℃,NaHCO3在水中的溶解度比Na2CO3的大B.石灰乳与Cl2的反应中,Cl2既是氧化剂
海水是一种丰富的资源 工业上从海水中可提取许多种物质 广泛应用于生活 生产 科技等方面。下图是某工厂
海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。回答下列问
下列有关钠及其化合物的说法中正确的是( )A.在Na2SO4 Na2O以及Na2O2中 阳离子与阴
下列有关钠及其化合物的说法中正确的是()A.在Na2SO4、Na2O以及Na2O2中,阳离子与阴离子的个数比均为2∶1B.实验桌上金属钠着火不能用常规灭火器灭火,
下列有关钠的叙述中 正确的是 [ ]A.钠的质地软 可用小刀切割 B.钠是一种灰黑色的固体
下列有关钠的叙述中,正确的是 [ ]A.钠的质地软,可用小刀切割 B.钠是一种灰黑色的固体 C.钠的化学性质非常活泼,在自然界钠可以以化合态和游离态
足量的二氧化碳通入到1mol/L NaOH溶液中 下列说法错误的是A.溶液中Na+离子个数为NA(N
足量的二氧化碳通入到1mol L NaOH溶液中,下列说法错误的是A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数)B.溶液中的CO32—离子浓度先增大后减小C












