近期 科学家用NaNO3和Na2O在573K反应制得了离子化合物Na3NO4。(1)经测定 Na3N
| 近期,科学家用NaNO3和Na2O在573K反应制得了离子化合物Na3NO4。 (1)经测定,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,则NO43-的电子式为______________________。 (2) Na3NO4与CO2能剧烈反应,并转化为常见物质,写出这个反应的化学方程式: ________________________________、_________________________________。 (3) Na3NO4与H2O能剧烈反应,并转化为常见物质,写出这个反应的化学方程式: ________________________________、_________________________________。 |
参考解答
(1) 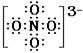 (2) Na3NO4+CO2==NaNO3+Na2CO3 (3) Na3NO4+H2O==NaNO3+2NaOH |
(1) 要书写NO43-的电子式,可以这样考虑:每个氮原子的价电子数为5,每个氧原子的价电子数为6,1个NO43-离子中,含有1个氮原子和4个氧原子,并带3个单位的负电荷,每个NO43-的电子总数为1×5+4×6+3=32,32可以写成4×8,根据题意可知,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,所以NO43-的电子式为: 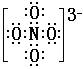 。 。(2) (3)根据“NaNO3和Na2O在573K反应制得了离子化合物Na3NO4”,可以把 Na3NO4的化学式改成NaNO3·Na2O,Na3NO4与CO2或H2O的反应,就可以看成是Na2O与CO2或H2O的反应,这样就可以顺利写出相应的化学方程式: Na3NO4+CO2==NaNO3+Na2CO3;Na3NO4+H2O==NaNO3+2NaOH |
相似问题
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验 请观察下图的实验装置、分析实验原理,下列说法错误的是()A.甲为
将甲烷 氧气 过氧化钠放入密闭容器中 在150 ℃条件下用电火花引发反应后 3种物质都恰好完全反应
将甲烷、氧气、过氧化钠放入密闭容器中,在150℃条件下用电火花引发反应后,3种物质都恰好完全反应,容器中的压强为零。则原混合物中3种物质的质量之比为
将a g含NaOH样品溶解在b mL 0.1 mol·L-1的硫酸中 再加入c mL 0.1 mol
将a g含NaOH样品溶解在b mL 0 1 mol·L-1的硫酸中,再加入c mL 0 1 mol·L-1的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是
200 ℃时 11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后 固体质量增加了3.
200 ℃时,11 6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了3 6 g。求混合物中CO2和H2O的质量比。
在1.00 L 1.00 mol·L-1 NaOH溶液中通入16.8 L标准状况下的CO2 计算所得
在1 00 L 1 00 mol·L-1 NaOH溶液中通入16 8 L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量分别为________。












