钛(Ti)具有高强度和耐酸腐蚀性 是重要的工业原料。以金红石(主要成分为TiO2 含少量Fe2O3
钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下: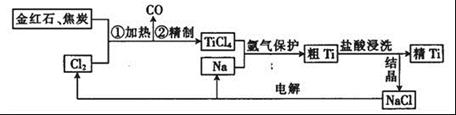 (1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:  从粗TiCl4中精制TiCl4的方法是________(填字母)。 A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液 (2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。 (3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:  (4)如图是一个制取氯气并以氯气为原料进行反应的装置, 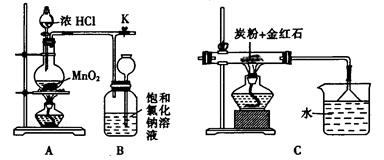 ①装置A中发生反应的化学方程式为_____________________________________。 ②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称) 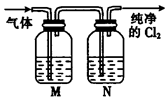 ③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。 |
参考解答
| (14分) (1)B(3分) (2)2Cl- -2e-= Cl2↑;钠(或Na)( 各2分) (3)1,6.1.2H+,2(3分) (4) ①4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O (2分) MnCl2+Cl2↑+2H2O (2分) ②饱和食盐水;浓硫酸(各1分) ③TiO2+2C+2 Cl2  TiCl4 +2CO(2分) TiCl4 +2CO(2分) |
试题分析: (1)结合杂质的性质,可以看出熔沸点相差较大,可采用蒸馏的方法; (2)惰性电极电解熔融NaCl时阳极放电的Cl-,2Cl- -2e-= Cl2↑;阴极产物为钠。 (3)根据化合价变化情况可得:分别为1,6.1.2H+,2 (4)①实验室制取氯气的反应4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O。 MnCl2+Cl2↑+2H2O。②除去氯气中氯化氢用饱和食盐水,干燥可用浓硫酸。 ③根据题意可得反应为:TiO2+2C+2 Cl2  TiCl4 +2CO TiCl4 +2CO |
相似问题
某含镍(Ni)废催化剂中主要含有Ni 还含有Al Al203 Fe及其他不溶于酸 碱的杂质。部分阳离
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al203、Fe及其他不溶于酸、碱的杂质。部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:欲从含镍废催化剂
空气吹出法工艺是目前“海水提溴”的最主要方法之一 其工艺流程如下:(1)目前 从海水中提取的溴约占世
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:(1)目前,从海水中提取的溴约占世界溴年产量的。(2)步骤①中用硫酸酸化可提高C
下列各组溶液 只用一种试剂无法区别的是A.硫酸钠 硫化钠 亚硫酸钾 硫代硫酸钾 偏铝酸钠B.氯化铁
下列各组溶液,只用一种试剂无法区别的是A.硫酸钠、硫化钠、亚硫酸钾、硫代硫酸钾、偏铝酸钠B.氯化铁、氯化铵、硫酸钠、硫酸镁、硫酸铝C.硫氰化钾、氯
分别取四种溶液于四支试管中进行实验 结论正确的是 操作现象结论A加入浓NaOH溶液 加热湿润的红色石
分别取四种溶液于四支试管中进行实验,结论正确的是操作现象结论A加入浓NaOH溶液,加热湿润的红色石蕊试纸变蓝原溶液中一定含有NH4+B加入稀盐酸,将产生
为除去某物质中所含的杂质 所选用的试剂或操作方法正确的是序号物质杂质除杂质应选用的试剂或操作方法①K
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是序号物质杂质除杂质应选用的试剂或操作方法①KNO3溶液KOH滴入稀HNO3同时用pH试纸测定至溶液呈












