食盐在生活中具有广泛的用途。(1)常温下 用氯化钠和水配制100 g溶质质量分数为5%的溶液时 必须
| 食盐在生活中具有广泛的用途。 (1)常温下,用氯化钠和水配制100 g溶质质量分数为5%的溶液时,必须用到的仪器有:托盘天平、药匙、胶头滴管、玻璃棒、量筒和 ,其中玻璃棒的作用是 。 (2)上述氯化钠来自于粗盐提纯,粗盐提纯的主要步骤是溶解、 和蒸发。在蒸发过程中,待蒸发皿中出现较多固体时,停止加热,这样操作的目的是 。 (3)海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线。 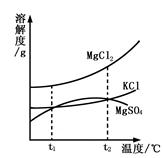 t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有 (填字母序号)。 A.MgCl2和KCl B.只有MgSO4 C.MgCl2、KCl和MgSO4 |
参考解答
| (1)烧杯 加速氯化钠固体的溶解 (2)过滤 利用蒸发皿的余热使滤液蒸干,防止飞溅 (两点答出其一即得1分) (3)MgCl2 C |
| (1)配制溶液用到的仪器有:托盘天平、药匙、胶头滴管、玻璃棒、量筒和烧杯;溶解时用玻璃棒搅拌是加速氯化钠固体的溶解 (2)粗盐提纯的主要步骤是溶解、过滤、蒸发;在蒸发操作时,待蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,防止飞溅 (3)饱和溶液溶质质量分数的计算方法是:  ,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体 ,所以溶解度大的,溶质质量分数就大,所以t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是氯化镁;将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,只要溶解度减小的都能析出晶体,由图示可知三种物质的溶解度都变小,都能析出晶体 |
相似问题
已知20℃时 硝酸钾的溶解度为31.6克 下列说法正确的是( )A.20℃时 100克硝酸钾饱和溶
已知20℃时,硝酸钾的溶解度为31 6克,下列说法正确的是( )A.20℃时,100克硝酸钾饱和溶液中含硝酸钾31 6克B.20℃时,68 4克水最多溶解31 6克硝酸
图1是t1℃时相同质量的甲 乙两物质同时放入100g水中的溶解情况 图2是它们的溶解度随温度变化的函
图1是t1℃时相同质量的甲、乙两物质同时放入100g水中的溶解情况,图2是它们的溶解度随温度变化的函数关系图,据此回答下列问题:图1 图2(1)图2中a、b
下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是A.NaCl的溶解度大于KNO3的溶解度B.
下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是A.NaCl的溶解度大于KNO3的溶解度B.t1℃时,KNO3饱和溶液中溶质的质量分数是20%C.在温度高于t2℃时
下图是A B两种固体物质的溶解度曲线图 请回答下列问题:(1)P点表示t1℃时 A的溶解度____B
下图是A、B两种固体物质的溶解度曲线图,请回答下列问题:(1)P点表示t1℃时,A的溶解度____B的溶解度(填“>”、“<”或“一”)。(2)在其他条件不变的情
右图是A B两种固体物质的溶解度曲线:(1)P点表示:t1℃时 两种物质的溶解度关系为b c(填“>
右图是A、B两种固体物质的溶解度曲线:(1)P点表示:t1℃时,两种物质的溶解度关系为bc(填“>”、“<”或“=”)。(2)将t1℃时接近饱和的c溶液变成












