(三选一)【物质结构与性质】三氟化氮是一种无色 无味 无毒且不可燃的气体 在半导体加工 太阳能电池制
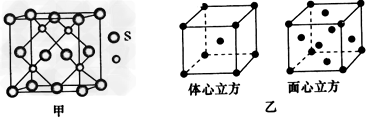
| (三选一)【物质结构与性质】 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到。 (1)写出制备NF3的化学反应方程式:__________。 (2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是_______________ (3)与铜属于同一周期的过渡元素,且各电子层均无未成对电子,该元素的基态原子核外电子排布式为____________;若该元素的硫化物具有如图甲所示的晶胞结构,则该晶胞中S2-的配位数为__________。若该金属单质的晶体在不同温度下有两种不同的堆积方式,其晶胞结构分别如图乙所示,则两晶胞中实际含有的原子个数之比为____________。 |
 |
| (4)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题 |
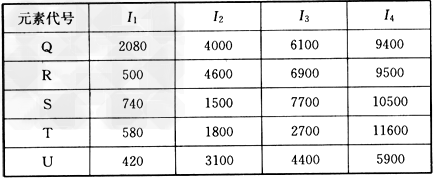 |
| ①在周期表中,最可能处于同一族的是______和_______。 ②T元素最可能是_____区元素。若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为_______,其中心原子的杂化方式为______。 |
参考解答
| (1)4NH3+3F2=NF3+3NH4F (2)NH3分子间能形成氢键,NF3分子间只有范德华力 (3)1s22s22p63s23p63d104s2{或[Ar3d104s2);4;1:2 (4)①R;U;②p;平面正三角形;sp2杂化 |
相似问题
【三选一—物质结构与性质】Ⅰ.A B C D为前四周期元素。A元素的原子价电子排布为ns2np2 B
【三选一—物质结构与性质】Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能
下列分子或离子中 中心原子含有孤电子对的是 [ ]A.H3O+ B.S
下列分子或离子中,中心原子含有孤电子对的是 [ ]A.H3O+B.SiH4 C.PH3D.SO42-
下列关于原子轨道的说法中正确的是[ ]A.凡是中心原子采取sp3杂化轨道成键的分子 其几何构
下列关于原子轨道的说法中正确的是[ ]A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体形 B.CH4分子中的sp3杂化轨道是由4个H原子的
溴化碘(IBr)的化学性质类似于卤素单质 试回答下列问题(1)溴化碘的电子式是___________
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题(1)溴化碘的电子式是____________;它是由____________键形成的____________分子(填“极性”
下列各组分子中 都属于含极性键的非极性分子的是 [ ]A.CO2 H2S B.C2H4 CH
下列各组分子中,都属于含极性键的非极性分子的是 [ ]A.CO2 H2S B.C2H4 CH4 C.C60 C2H4D.NH3 HCl












