【三选一—物质结构与性质】Ⅰ.A B C D为前四周期元素。A元素的原子价电子排布为ns2np2 B
| 【三选一—物质结构与性质】 Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题: ⑴当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_______个π键。A6H6分子中A原子的杂化轨道类型是_______杂化。 ⑵当n=3时,A与B形成的晶体属于_______晶体。 ⑶若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。 Ⅱ.⑴下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__________(请用相应的编号填写) |
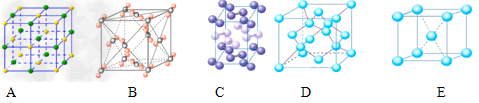 |
| ⑵①与N2O互为等电子体的阴离子为______________(填一种即可);②根据价层电子对互斥模型确定ClO3-离子的空间构型为______________。 ⑶已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为___________。 ⑷下图是金属铝晶体结构的示意图。已知金属铝的密度为2.7g/cm3,则紧邻的铝原子的半径为_____________cm。(已知 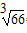 =4.04) =4.04) |
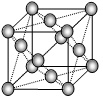 |
参考解答
| Ⅰ⑴非极性;2;sp2; ⑵原子; ⑶P>S>Si Ⅱ⑴BC;⑵①SCN-或N3-; ②三角锥形;⑶ [Ar3d6; ⑷1.42×10-8 |
相似问题
下列分子或离子中 中心原子含有孤电子对的是 [ ]A.H3O+ B.S
下列分子或离子中,中心原子含有孤电子对的是 [ ]A.H3O+B.SiH4 C.PH3D.SO42-
下列关于原子轨道的说法中正确的是[ ]A.凡是中心原子采取sp3杂化轨道成键的分子 其几何构
下列关于原子轨道的说法中正确的是[ ]A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体形 B.CH4分子中的sp3杂化轨道是由4个H原子的
溴化碘(IBr)的化学性质类似于卤素单质 试回答下列问题(1)溴化碘的电子式是___________
溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题(1)溴化碘的电子式是____________;它是由____________键形成的____________分子(填“极性”
下列各组分子中 都属于含极性键的非极性分子的是 [ ]A.CO2 H2S B.C2H4 CH
下列各组分子中,都属于含极性键的非极性分子的是 [ ]A.CO2 H2S B.C2H4 CH4 C.C60 C2H4D.NH3 HCl
判断AB2型分子是极性分子的主要依据是[ ]A.分子中存在极性键B.分子中存在非极性键 C.
判断AB2型分子是极性分子的主要依据是[ ]A.分子中存在极性键B.分子中存在非极性键 C.直线形结构D.非直线形结构












