如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分 图上标有第ⅥA族和几种元素的
如图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题: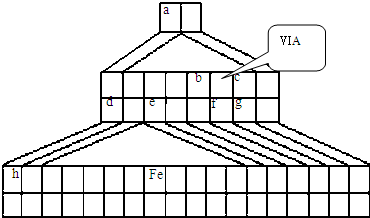 (1)如图中将铁元素在周期表中的位置是______ (2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式______ (3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,该盐溶于水时______(“抑制”、“促进”或“不影响”)水电离,其反应的离子方程式为______. (4)下列叙述正确的是______. A.h的最高价氧化物对应的水化物是一种强碱 B.f的氢化物比硒化氢的稳定性弱 C.c的氢化物的水溶液是强酸 D.原子半径:h>e>a E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g (5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为:______. |
参考解答
| (1)由图可知铁元素在第四周期,第8列,则位置为第4周期第族,故答案为:第4周期第Ⅷ族; (2)由信息可知,NaH为离子化合物,钠失去电子,氢得到电子,其电子式为Na+[:H-,故答案为:Na+[:H-; (3)因b为N元素,b元素的氢化物与其最高价氧化物的水化物可生成一种盐为硝酸铵,铵根离子水解时结合水电离生成的氢氧根离子,从而促进水的电离,水解离子反应为NH4++H2O 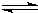 NH3?H2O+H+, 故答案为:促进;NH4++H2O 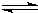 NH3?H2O+H+; (4)A、因H为钾元素,则最高价氧化物对应的水化物是KOH,KOH为强碱,故A正确; B、f为硫,硫与硒在同一主族,非金属性S>Se,则S的氢化物比硒化氢的稳定性强,故B错误; C、c为氟,其氢化物为HF,HF的水溶液中电离不完全,则HF为弱酸,故C错误; D、h为第四周期元素,有4个电子层,e为第三周期元素,a为第一周期元素,有1个电子层,电子层越多,半径越大,即原子半径为h>e>a,故D正确; E、d与f形成的化合物为硫化钠,d与g形成的化合物为氯化钠,硫离子水解则硫化钠溶液的pH>7,氯离子不水解,氯化钠溶液为中性,说明相同浓度氢化物水溶液的酸性f弱于g,故E正确;故答案为:A、D、E; (5)d为钠,d的某化合物呈淡黄色,则该化合物为过氧化钠,与氯化亚铁的物质的量之比为1:2,且无气体生成,则发生的反应为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+. |
相似问题
有位于20号元素前 原子序数依次递增的A B C D E五种元素.A C元素的电子层数相同;A E两
有位于20号元素前,原子序数依次递增的A、B、C、D、E五种元素.A、C元素的电子层数相同;A、E两元素的最外层和次外层电子数相同;A和C可形成化合物AC,D
A B C D E五种元素原子序数逐渐增大 且均不超过18.其中A与C B与E分别为同族元素.原子半
A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D
现有四种元素基态原子电子排布式如下:①1s22s22p63s23p4; ②1s22s22p63s23
现有四种元素基态原子电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是( )A.第一电离
元素的性质呈周期性变化的根本原因是( )A.元素的金属性和非金属性呈周期性变化B.元素的原子半径呈
元素的性质呈周期性变化的根本原因是( )A.元素的金属性和非金属性呈周期性变化B.元素的原子半径呈周期性变化C.元素原子的核外电子排布呈周期性变
在学习核外电子排布知识时 甲 乙两小组对多电子原子的能级的有关知识产生了分歧:甲组认为第3周期元素的
在学习核外电子排布知识时,甲、乙两小组对多电子原子的能级的有关知识产生了分歧:甲组认为第3周期元素的基态原子中,不可能出现d电子,而乙组认为第3周












