W X Y Z为短周期内除稀有气体外的4种元素 它们的原子序数依次增大 其中只有Y为金属元素;Z元素
| W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素;Z元素的最高正化合价为+6.Y和W的最外层电子数相等.Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍.由此可知: (1)写出元素符号:W为______,X为______,Y为______,Z为______; (2)Y2Z是由______键组成的物质,其电子式为______; (3)由Y、X、W组成的物质中有______键和______键,形成的是______化合物; (4)用电子式表示Z与钙形成化合物的过程______. |
参考解答
| 短周期的金属只有Li、Be、Na、Mg、Al,Y和W的最外层电子数相等即W和Y同族,所以W只能是H(氢),因不存在稀有气体,所以如果Y是Li,X就成了稀有气体,不成立,所以Y是Na,Y的质子数是11,W的质子数是1,X的质子数有可能是5,6,7,8,9,那么Y+Z就应该有18,21,24、27,30等可能,但Z一定大于Y,也就是12以上,算到最大的短周期元素Cl也只有17,加起来是28,那么Y+Z就一定小于等于28,28不是3的倍数,有24,27两1,7,11,13(铝)不成立,1,8,11,16 成立,所以W、X、Y、Z分别为:H,O,Na,S. (1)W、X、Y、Z分别为:H,O,Na,S,故答案为:H;O;Na;S; (2)Na2S是由钠离子和硫离子通过离子键组成的物质,其电子式为: 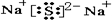 ,故答案为:离子键; 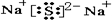 ; (3)NaOH中钠离子和氢氧根离子之间存在离子键,氢氧根离子中氧原子和氢原子之间存在共价键,NaOH为离子化合物,故答案为:离子;共价;离子. (4)用电子式表示CaS的形成过程为:  ,故答案为:  . |
相似问题
短周期元素X Y Z W的原子序数依次增大 X 原子的最外层电子数是其内层电子总数的3倍 Y原子的最
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一
X Y Z三种短周期元素 X元素的原子最外层只有一个电子 Y元素的原子M电子层的电子数为K L上电子
X、Y、Z三种短周期元素,X元素的原子最外层只有一个电子,Y元素的原子M电子层的电子数为K、L上电子总数的一半,Z元素的原子L层电子数比Y原子L层电子数少2
A B C D是四种短周期元素 它们的原子序数依次增大 其中A C与B D分别是同主族元素 又知B
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子
a元素的阴离子 b元素的阴离子与c元素的阳离子具有相同的电子层结构.已知a的原子序数大于b的原子序数
a元素的阴离子、b元素的阴离子与c元素的阳离子具有相同的电子层结构.已知a的原子序数大于b的原子序数,则a、b、c三种离子半径大小顺序( )A.a>b>
有a b c d四种元素.a b的阳离子与c d的阴离子具有相同的电子层结构;a的阳离子的正电荷数小
有a、b、c、d四种元素.a、b的阳离子与c、d的阴离子具有相同的电子层结构;a的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴












