为了测定黄铜(铜 锌合金)的组成 某研究性学习小组称取该样品10g 向其中逐滴加入9.8%的稀硫酸至
| 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算: (1)样品中铜的质量分数; (2)反应所消耗的硫酸溶液质量; (3)反应后所得溶液的溶质的质量分数. 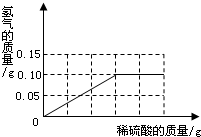 |
参考解答
答案:
(1)67.5%
(2)50g
(3)约15.1%
解析:
(1)由图示可知生成氢气的质量为0.2g,根据氢气算出锌的质量,再用样品的质量减去锌的质量算出铜的质量,再计算质量分数.
设要生成0.2g氢气需要锌的质量为X则:
Zn+H 2 SO 4 ═ZnSO 4 +H 2 ↑
65 2
X 0.2g
根据:![]() =
=![]()
解得X=6.5g,铜质量为:20g-6.5g=13.5g,所以样品中铜的质量分数:![]() ×100%=67.5%.
×100%=67.5%.
(2)(2) ![]() =
=![]() ,y=50g
,y=50g
(3)![]() =
=![]() ,z=8.05g
,z=8.05g
所得溶液的溶质质量分数为:![]() ×100%≈15.1%
×100%≈15.1%
相似问题
下列反应发生后 溶液的总质量会减少的是( )A.Fe+H2SO4B.Fe+AgNO3C.Fe(OH
下列反应发生后,溶液的总质量会减少的是( )A.Fe+H2SO4B.Fe+AgNO3C.Fe(OH)3+HClD.Fe2O3+HNO3
石灰石是工业上的一种重要原料 其主要成分是碳酸钙.小黄为了测定从某矿山采来的石灰石中碳酸钙的质量分数
石灰石是工业上的一种重要原料,其主要成分是碳酸钙.小黄为了测定从某矿山采来的石灰石中碳酸钙的质量分数,将样品与稀盐酸放在烧杯中反应进行实验,测
现有铁和铜的金属混合物共80g 将它们放入足量的稀硫酸中 产生气体2g 问 其中铜的质量分数是多少?
现有铁和铜的金属混合物共80g,将它们放入足量的稀硫酸中,产生气体2g,问,其中铜的质量分数是多少?
硫酸钾(K2SO4)是一种常见钾肥 常含有一定量的杂质(假定杂质都是NaCI).某厂生产的硫酸钾包装
硫酸钾(K2SO4)是一种常见钾肥,常含有一定量的杂质(假定杂质都是NaCI).某厂生产的硫酸钾包装袋上标有“K2SO4含量≥95%”.为判断“K2SO4含量≥95%”
下列叙述中 符合质量守恒定律的是( )A.2g碳与4g氧气反应生成6g二氧化碳B.5g酒精与5g水
下列叙述中,符合质量守恒定律的是( )A.2g碳与4g氧气反应生成6g二氧化碳B.5g酒精与5g水混合得到10g酒精溶液C.高锰酸钾加热分解后,试管内固体药












