用某金属颗粒与足量稀盐酸反应 如生成氢气质量与所用金属质量之间关系如图 该金属颗粒可能是( )A.
用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是( )
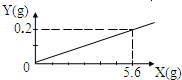 |
参考解答
依据氢气的质量=
A、设生成0.2g氢气需要金属锌的质量为x, Zn+2HCl═ZnCl2+H2↑ 65 2 x 0.2g
x=6.5g 故A错误; B、设生成0.2g氢气需要金属镁的质量为z, Mg+2HCl═MgCl2+H2↑ 24 2 z 0.2g
x=2.4g 结合A的计算可知5.6g镁锌的混合物可以制得0.2g氢气; C、设生成0.2g氢气需要金属铁的质量为y, Fe+2HCl═FeCl2+H2↑ 56 2 y 0.2g
x=5.6g 所以纯铁适合; D、根据A计算可以看出,产生0.2g氢气需要纯锌的质量是6.5g,铜不与酸反应生成氢气,则5.6g含铜的锌不可能生成0.2g氢气,故D错误; 故选BC |
相似问题
实验室现需1.12L纯净的氧气(标准状况下 氧气的密度是1.429g/L).某同学用质量比为3:1的
实验室现需1 12L纯净的氧气(标准状况下,氧气的密度是1 429g L).某同学用质量比为3:1的氯酸钾和二氧化锰制取氧气,并回收二氧化锰和氯化钾.下表为该
用1000t含氧化铁80%的赤铁矿石 理论上可以炼出含铁96%的生铁的质量是多少?
用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
试剂瓶上的标签如下 请计算:(1)该瓶溶液中硫酸溶液的质量是______克.(2)欲配制200g溶质
试剂瓶上的标签如下,请计算:(1)该瓶溶液中硫酸溶液的质量是______克.(2)欲配制200g溶质质量分数为19 6%的稀硫酸,需这种浓硫酸的质量是______克.
在处理实验后的废液时 用PH试纸检测 发现废液PH<5(主要成分为稀硫酸) 每用去100克质量分数为
在处理实验后的废液时,用PH试纸检测,发现废液PH<5(主要成分为稀硫酸),每用去100克质量分数为14 8%石灰水就可以处理200克的废液,这种废液中硫酸的
原煤燃烧产生的二氧化硫是造成大气污染的重要原因.二氧化硫又是重要的化工原料 可以生产硫酸 在工业上有
原煤燃烧产生的二氧化硫是造成大气污染的重要原因.二氧化硫又是重要的化工原料,可以生产硫酸,在工业上有重要用途.用硫生产硫酸的总反应可以表示为;2












