向20mL盐酸和硫酸的混合酸溶液中 渐渐加入0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶
| 向20mL盐酸和硫酸的混合酸溶液中,渐渐加入 0.1mol/L的Ba(OH)2溶液。生成沉淀的质量和溶液的pH变化曲线如右图。根据此实验数据计算: 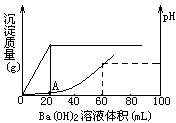 (1)原溶液中硫酸和盐酸的浓度各为多少_________________。 (2)A点处溶液的pH是______________。 |
参考解答
| (1)c(H2SO4)='0.1mol/L ' c(HCl)='0.4mol/L ' (2) pH=0.7 |
| 本题以图示形式检查酸、碱中和生成沉淀质量和溶液pH曲线随加入Ba(OH)2溶液体积变化情况,此题属于理解层次的中等难度试题。 (1)依据图示,沉淀最大时已加入Ba(OH)2溶液20mL,混合酸中硫酸被完全中和。所以原混合酸中硫酸的物质的量浓度为0.1mol/L。 当H2SO4刚被Ba(OH)2溶液中和时,可以认为溶液中盐酸未被中和。从20mL起,再加Ba(OH)2溶液至60mL时溶液中盐酸全被中和完,溶液呈中性,pH=7,所以原混合酸中盐酸的物质的量浓度为0.4mol/L。 (2)A点处溶液中氢离子浓度是盐酸提供的,因H2SO4刚被Ba(OH)2溶液中和,溶液被冲稀,体积扩大到原来的2倍,则盐酸浓度缩小到原来的1/2,由原来的0.4mol/L变为0.2mol/L。即氢离子浓度为0.2mol/L。所以pH=0.7。 |
相似问题
下列关于氯气的描述中正确的是( )A.氯气以液态形式存在时 可称作液氯B.红热的铁丝在氯气中燃烧后
下列关于氯气的描述中正确的是( )A.氯气以液态形式存在时,可称作液氯B.红热的铁丝在氯气中燃烧后生成氯化亚铁C.氯气不能与非金属反应D.Cl2是一
漂白粉在潮湿的空气中易变质失效 请回答:存放环境中①有水蒸气无二氧化碳②有二氧化碳无水蒸气 哪种情况
漂白粉在潮湿的空气中易变质失效,请回答:存放环境中①有水蒸气无二氧化碳②有二氧化碳无水蒸气,哪种情况下漂白粉更易变质?为什么?
在氯水中存在多种分子和离子 可通过实验的方法加以确定 下列说法中可能错误的是( )A.加入含有Na
在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在B.加入有
氯水具有多种性质 根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):(1)a b c中反应的
氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):(1)a、b、c中反应的离子方程式为:______e中的化学反应方程式为______
为了制得氯气并探究氯气的一些化学性质 某学生用如图所示装置进行有关实验 打开A的玻璃塞 将A中浓盐酸
为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:(1)












