已知:E为常见金属 C D F I均为常见气体 其中C D为单质 F I为化合物 且组成元素相同 D
已知:E为常见金属,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子,它们有如下框图关系: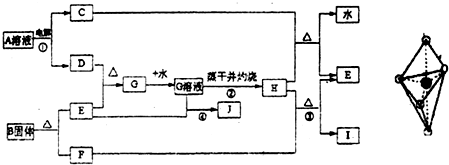 (1)H的颜色是______;B的化学式是______;I的电子式是______. (2)反应①阳极的电极反应式______. (3)反应③的化学方程式是______,该反应在工业上的用途是______. (4)反应④的离子方程式______. (5)从G溶液制得G的结晶水合物的操作是______. (6)反应②蒸干并灼烧最终得H而不是无水的G,试用简要文字和方程式解释:______. |
参考解答
(1)由电解生成D并且有毒,则D应为氯气,I为直线型非极性分子,则应为CO2,其电子式为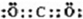 ,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,为红棕色固体,J为 FeCl2,C为H2,B分解生成Fe和CO,根据其结构模型可推知为Fe(CO)5; 故答案为:红棕色;Fe(CO)6; 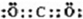 ; (2)根据题意,电解A溶液生成氢气和氯气,电解时阳极发生氧化反应,Cl-放电生成Cl2,故答案为:2Cl--2e-═2Cl2↑; (3)工业炼铁是用还原性气体和CO在高温条件下发生氧化还原反应生成Fe,根据质量守恒定律可写出化学方程式,故答案为:Fe2O3+3CO
(4)反应④为Fe3+和Fe发生氧化还原反应生成e2+,故答案为:2Fe3++Fe═3Fe2+; (5)氯化铁在加热下易发生水解生成Fe(OH)3,为防止FeCl3水解,应在酸性条件下进行加热浓缩,并进行结晶和过滤,最后才能得到氯化铁晶体,故答案为:在加入盐酸后的溶液中蒸发浓缩、冷却结晶、过滤干燥.; (6)加热条件下,氯化铁水解生成Fe(OH)3,Fe(OH)3不稳定,在灼烧时发生分解生成Fe2O3,故答案为:因为加热时发生FeCl3+3H2O═Fe(OH)3↓+3HCl↑,这是个完全水解过程,加热蒸干后生成了Fe(OH)3,灼烧时发生了2Fe(OH)3
|
相似问题
将下列离子方程式改写成化学方程式 正确的是( )A.Cu2++2OH-═Cu(OH)2↓;CuCO
将下列离子方程式改写成化学方程式,正确的是( )A.Cu2++2OH-═Cu(OH)2↓;CuCO3+2NaOH═Cu(OH)2↓+Na2CO3B.CO32-+2H+═H2O+CO2↑;BaCO3+2HCl
化学用语是学习化学的重要工具 下列化学用语中 正确的是( )A.NH4+的水解反应离子方程式:NH
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )A.NH4+的水解反应离子方程式:NH4++H2O?NH3?H2O+H+B.在AgCl悬浊液中加入KI溶液充分振
下列离子方程式书写正确的是( )A.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2
下列离子方程式书写正确的是( )A.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2OB.向氢氧化亚铁中加入足量的
在水溶液中 下列电离方程式正确的是( )A.NaHCO3=Na++H++CO32-B.Ba(NO3
在水溶液中,下列电离方程式正确的是( )A.NaHCO3=Na++H++CO32-B.Ba(NO3)2=Ba+2+2NO3-C.AlCl3=Al3++Cl3-D.Fe2(SO4)3=2Fe3++3SO42-
四种短周期元素A B C D的性质或结构信息如下.信息①原子半径大小:A>B>C>D信息②四种元素之
四种短周期元素A、B、C、D的性质或结构信息如下.信息①原子半径大小:A>B>C>D信息②四种元素之间形成的某三种分子的比例模型及部分性质:请根据上述












