四种短周期元素A B C D的性质或结构信息如下.信息①原子半径大小:A>B>C>D信息②四种元素之
| 四种短周期元素A、B、C、D的性质或结构信息如下. 信息①原子半径大小:A>B>C>D 信息②四种元素之间形成的某三种分子的比例模型及部分性质:  请根据上述信息回答下列问题. (1)①C元素在周期表中的位置______,请写出BC2分子的电子式______. ②A元素的单质与物质甲发生反应的离子方程式______. ③以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,写出电池的电极反应式.负极______;正极______ (2)A所在周期中,E元素的单质还原性最强,A、E单质反应得到的化合物M是一种重要的化工原料,如图是电解100ml饱和M溶液的装置,X、Y都是惰性电极,实验开始时,同时在两边各滴入几滴酚酞试液,则 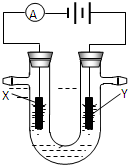 ①电解池中Y极上的电极反应式______.检验Y电极反应产物的方法是______. ②电解一段时间后,若阴极收集到112ml标准状况下的气体,此时电解液的PH为______(假设电解液的体积保持不变,常温下) |
参考解答
| 甲是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,应是H2O,根据结构和用途可知,乙是CH4,丙是强氧化性弱酸,可以用于消毒杀菌,应是HClO,则这四种元素分别为H、C、O、Cl,根据原子半径大小顺序可知A是Cl,B是C,C是O,D是H, (1)①C是O元素,核外有2个电子层,最外层电子数为6,应位于第二周期ⅥA族,B、C形成的化合物为CO2,为共价化合物,电子式为 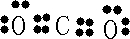 , 故答案为:第二周期ⅥA族;  ; ②Cl2与水反应生成HCl和HClO,其中HCl为强酸,完全电离,HClO为弱酸, 反应的离子方程式为Cl2+H2O  H++Cl-+HClO, 故答案为:Cl2+H2O  H++Cl-+HClO; ③CH4具有还原性,在反应中易被氧化而失去电子,作原电池的负极,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,O2具有氧化性,作原电池的正极,发生还原反应, 电极反应式为2O2+8e-+4H2O=8OH-, 故答案为:CH4-8e-+10OH-=CO32-+7H2O;2O2+8e-+4H2O=8OH-; (2)①A所在周期中,E元素的单质还原性最强,则E为Na元素,该电解质溶液为NaCl溶液,电解时阳极反应为2Cl-2e-=Cl2↑,Cl2具有强氧化性,可用湿润的碘化钾淀粉试纸放在Y电极附近检验,现象是试纸变蓝色, 故答案为:2Cl-2e-=Cl2↑; 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色; ②电解时,阴极反应为:2H2O+2e-=2OH-+H2↑,生成氢气的物质的量为
则n(OH-)=2(H2)=2×0.005mol=0.01mol,c(OH-)=
根据c(OH-)?c(H+)=1×10-14,则c(H+)=1×10-13mol/L, PH=-lg(10-13)=13, 故答案为:13 |
相似问题
下列离子方程式正确的是( )A.将固体CuO加入稀H2SO4中CuO+2H+=Cu2++H2OB.
下列离子方程式正确的是( )A.将固体CuO加入稀H2SO4中CuO+2H+=Cu2++H2OB.盐酸滴加在石灰石上CaCO3+2H+=Ca2++H2CO3C.Ba(OH)2溶液与稀硫酸混合Ba2
Ⅰ.氮是地球上含量丰富的一种元素 氮及其化合物在工农业生产 生活中有着重要作用.请回答:(1)在一定
Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(
下列离子方程式书写正确的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HC
下列离子方程式书写正确的是( )A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-NH3↑+CO32-+2H2OB.明矾溶液中加入氢氧化钡:Ba2++SO42-=
下列离子方程式与所述事实相符且正确的是( )A.向NaHCO3溶液中滴加少量澄清石灰水:2HCO3
下列离子方程式与所述事实相符且正确的是( )A.向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2OB.Na2S溶液吸收足量SO2:
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂 极易溶于水 作为工业和生活污水处理等领域
黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.SPFS可表示成Fex(OH)y(SO4)z?












