合成氨是重要的化学工业 为了研究合成氨的反应原理 在一密闭容器内充入1 mol N2和2 mol H
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2 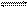 2NH3。 2NH3。Ⅰ:若维持温度不变,且密闭容器的容积固定为1  L。 L。(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。 (2)如果开始时,向该容器内加入0.5 moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mo  l和NH3 _______mol。 l和NH3 _______mol。(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。 Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。 (4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号) (甲)大于0.2 mol (乙)等于0.2 mol (丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol 作出此判断的理由是__________________________________________。 |
参考解答
(1)0.15 mol·L-1·min-1 (2分) (2) 0.5 1.0 (4分) (3)a +c='1 ' b+ c='2' (3分) (4)甲 温度不变时,随反应的进行,容器体积减小,体系压强比平衡(1)时增大,平衡向正反应方向移动 (4分) |
| 略 |
相似问题
1 mol X跟a mol Y在体积可变的密闭容器中发生如下反应: X(g) + a Y(g) b
1 mol X跟a mol Y在体积可变的密闭容器中发生如下反应: X(g) + a Y(g) b Z(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还
已知298 K时 2SO2(g)+O2(g)2SO3(g) ΔH='-197' kJ·mol-1。在
已知298 K时,2SO2(g)+O2(g)2SO3(g)ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO2和1 mol O2达到平衡时,反应放
(14分)随着人类对温室效应和资源短缺等问题的重视 如何降低大气中CO2的含量及有效地开发利用CO2
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注⑴目前工业上有一种方法是用CO2来
在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H
在一定条件下将1mol的CO和水蒸气放入密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g),达到平衡时测得CO2为 0 6mol,再通入4mol水蒸气,达到平衡后,CO
下列反应达到平衡后 降低温度或减小压强都能使平衡向逆反应方向移动的是A.3O2(g) 2O3(g)(
下列反应达到平衡后,降低温度或减小压强都能使平衡向逆反应方向移动的是A.3O2(g) 2O3(g)(正反应为吸热反应) B.2NO2(g) N2O4(g) (正反应为放热反应












