(16分)氨气是一种重要的基础化工原料 用途广泛。(1)在微电子工业中 氨水可作刻蚀剂H2O2的清除
| (16分)氨气是一种重要的基础化工原料,用途广泛。 (1)在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3 + 3H2O2= +6H2O (2)工业中常用以下反应合成氨:N2+3H2  2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。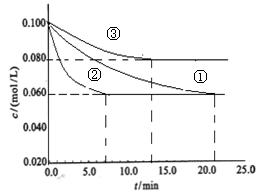 该反应平衡常数的数学表达式为 ;实验②平衡时H2的转化率为_____ 。 (3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。 ②条件:_______ 理由: ________ ③条件:_______ 理由: ________ |
参考解答
| .(16分) (1)2NH3 + 3H2O2 =' ' N2 + 6H2O (2分) (2)K = 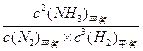 (3分) 40% (3分) (3分) 40% (3分)(3)②:加了催化剂(2分);因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以①②两装置达到平衡时N2的浓度相同。(2分) ③:温度高(2分);该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①。(2分) |
| 略 |
相似问题
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中 分别加入amol X和amol Y 起始时两
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入amol X和amol Y,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2X(?)+Y
在容积为1L的固定密闭容器中充入2mol氨气 在一定条件下发生反应:N2(g)+3H2(g)2NH3
在容积为1L的固定密闭容器中充入2mol氨气,在一定条件下发生反应:N2(g)+3H2(g)2NH3(g),达到平衡时容器内c(N2)为0 5mol L,若温度和体积不变,按下列物
有一化学平衡mA(g)+nB(g)pC(g)+qD(g) 如图所示是A的转化率同压强 温度的关系 分
有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图可以得出的正确结论是A.正反应吸热,m
已知 :N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。(1) 在5
已知 :N2(g)+3H2(g) 2NH3(g)ΔH=-92 kJ·mol-1。(1) 在500℃、2 02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平
COCl2(g) CO(g)+Cl2(g)- Q 当反应达到平衡时 分别采取下列措施 能使平衡向正反
COCl2(g) CO(g)+Cl2(g)- Q,当反应达到平衡时,分别采取下列措施,能使平衡向正反应方向移动的是A.恒容通入氮气B.恒压通入氮气C.加催化剂D.增加CO的浓度












