(共8分)(1)(3分)有反应:2NO2N2O4 △H
| (共8分) (1)(3分)有反应:2NO2  N2O4 △H<0,根据图像判断后填空: N2O4 △H<0,根据图像判断后填空:
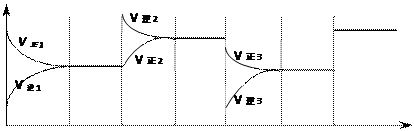 t1 t2 t3 t4 t5 t6 t t1 t2 t3 t4 t5 t6 tt1至t3采取的措施是_____________;t4至t5采取的措施是______________t6采取的措施是_________________。 (2)(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol ②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol 请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 。 (3)(2分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。则该反应的化学方程式为________________________。 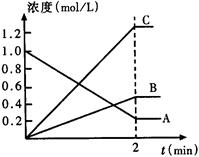 |
参考解答
| (1)①增大生成物的浓度②降温,③加入催化剂 (2)FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-218 kJ/mol (3)2A  B + 3C B + 3C |
| 略 |
相似问题
373K时 某 1L密闭容器中加入1molPCl5发生如下可逆反应:其中物质PCl3的物质的量变化如
373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应:其中物质PCl3的物质的量变化如右图所示。(1)前 20 s内 PCl5(g)的平均反应速率为(2)373
将等物质的量的F2和ClF混合 在密闭容器中发生反应:F2(g)+ClF(g)ClF3(g);△H
将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g)ClF3(g);△H<0。下列叙述中正确的是A.恒温恒容,当ClF 转化40% 时,容器内的压强为
(13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品 从而提高了煤的利用率。(1)将水蒸气
(13分)煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。(1)将水蒸气通过红热的碳即可产生水煤气。反应为: C(s)+H
(1)某温度下 密闭容器中 发生如下可逆反应:2E(g)F(g) + xG(g) △H<0。若起始
(1)某温度下,密闭容器中,发生如下可逆反应:2E(g)F(g) + xG(g), △H<0。若起始时E的浓度为a mol L,F ,G浓度均为0,达平衡时E浓度为0 5a
在2L容器中 放入0.4molA和0.6molB 在一定温度下 压强为P 发生反应:2A(g)+3B
在2L容器中,放入0 4molA和0 6molB,在一定温度下,压强为P,发生反应:2A(g)+3B(g) x C(g)+2D(g),在10min后,容器中c(A)="0 1" mol·L-1












