在80℃时 0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中 隔一段时间对该容器
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s—40s内用N2O4表示的平均反应速率为 。 (2)计算在 80℃时该反应的平衡常数K 。 (3)能判断该反应是否已达化学平衡状态的依据是________________。 a.容器中压强不变 b.混合气体中c(N2O4)不变 c.v正(NO2)=v逆(N2O4) d.混合气体密度不变 e.混合气体的平均摩尔质量不变 f.c(N2O4)= c(NO2) (4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。 (5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。 A.增大N2O4的起始浓度 B.向混合气体中通入NO2 C.使用高效催化剂 D.升高温度 (6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。 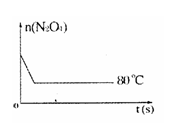 |
参考解答
| (1)0.0020mol·L-1·s-1(或0.12mol·L-1·min-1)(有效数字为2位,有误的扣1分) (2)1.8mol·L-1 abe (4)变浅 (5)D、A B (6) 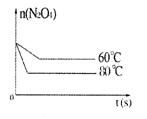 |
| 本题考查可逆反应的平衡条件 ⑴当 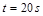 时,已生成的 时,已生成的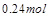 的 的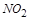 ,由反应的化学方程式 ,由反应的化学方程式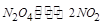 知此时当有 知此时当有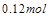 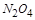 发生的反应;当 发生的反应;当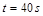 时,剩余的 时,剩余的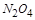 为 为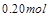 ,则 ,则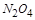 的变化量为 的变化量为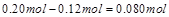 ,这 ,这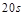 内 内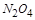 发生反应的平均速率为 发生反应的平均速率为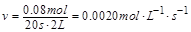 . .⑵由反应的化学方程式 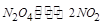 知,当 知,当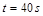 时, 时,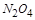 的变化量为 的变化量为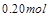 ,则生成的 ,则生成的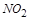 为 为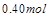 ,即 ,即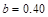 ;同理可得 ;同理可得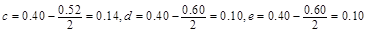 由表中数据可知,当 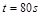 后,反应达到平衡,此时 后,反应达到平衡,此时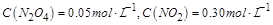 ,所以平衡常数为 ,所以平衡常数为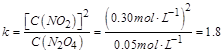 ⑶由反应的化学方程式 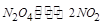 知,反应的前后体积有变化,容器中压强不变时可确定反应达到的平衡状态,故 知,反应的前后体积有变化,容器中压强不变时可确定反应达到的平衡状态,故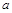 正确; 正确;混合气体中c(N2O4)不变,表明 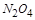 分解为 分解为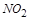 的速度与 的速度与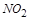 合成为 合成为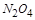 的速度相同,即下正逆反应的相等,故反应达到的平衡状态,所以 的速度相同,即下正逆反应的相等,故反应达到的平衡状态,所以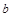 正确; 正确;由于 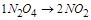 ,所以v正(NO2)=v逆(N2O4)时表明正反应的速度大于逆反应的速度,反应没有达到平衡,故 ,所以v正(NO2)=v逆(N2O4)时表明正反应的速度大于逆反应的速度,反应没有达到平衡,故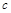 错; 错;由于反应在密闭容器中进行,所以混合气体的密度始终保持不变,故 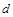 错; 错;混合气体的平均摩尔质量不变,表明混合气体的物质的量保持不变,正逆反应的速度相等相等,反应达到的平衡状态,故 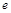 正确; 正确;当c(N2O4)= c(NO2)时,仅能说明 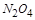 的转化率为 的转化率为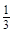 ,不能说明反应达到的平衡状态,故 ,不能说明反应达到的平衡状态,故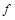 错. 错.⑷ 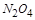 转化为 转化为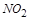 的反应是吸热反应,因而温度降低, 的反应是吸热反应,因而温度降低,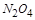 的转化率降低, 的转化率降低,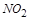 的浓度变小,故颜色变浅; 的浓度变小,故颜色变浅;⑸化学平衡常数只与温度有关,温度一定,则 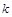 为定值,因而 为定值,因而 均不正确, 均不正确,升高系统温度,有利于正反应进行,平衡向生成 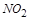 的方向移动, 的方向移动,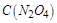 变小, 变小,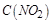 变大,因而 变大,因而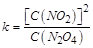 变大 变大故正确答案为D ⑹ 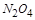 转化为 转化为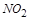 的反应是吸热反应,温度越低,越不利于 的反应是吸热反应,温度越低,越不利于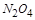 的转化,因而平衡时 的转化,因而平衡时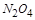 的浓度越高,同时达到平衡的时间也越长. 的浓度越高,同时达到平衡的时间也越长.故有如下之图:  |
相似问题
(8分)在密闭容器中 由一定起始浓度的氙(Xe)和F2反应 可得到3种氟化物。各种生成物在平衡体系内
(8分)在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等
下列说法正确的是A.△H>0的反应 常温下一定不能自发进行B.用0.1mol/LNaOH溶液分别滴定
下列说法正确的是A.△H>0的反应,常温下一定不能自发进行B.用0 1mol LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴
对于反应2A(g) + xB(g)4C(g)达到平衡时 C的浓度为1.2 mol·L-1 当其它条件
对于反应2A(g) + xB(g)4C(g)达到平衡时 C的浓度为1 2 mol·L-1,当其它条件不变,把体积扩大1倍时,测得C的浓度为0 7 mol·L-1,则x的值为()A 1 B 2 C 3 D 4
下列说法正确的是A.H2S的水溶液中 c(H+)与c(S2—) 之比为2:1B.( NH4)2SO4
下列说法正确的是A.H2S的水溶液中,c(H+)与c(S2—) 之比为2:1B.( NH4)2SO4溶液中c(NH4+)与c(SO42—) 之比为2:1C.一定温度下,将SO3 (g)放入密闭
在一定温度下 把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中 活塞的一端与
在一定温度下,把2 0体积的N2和6 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H22NH3。已知平衡时












