如图甲 乙是电化学实验装置。(1)若甲 乙两烧杯中均盛有NaCl溶液 则:①甲中石墨棒上的电极反应式
如图甲、乙是电化学实验装置。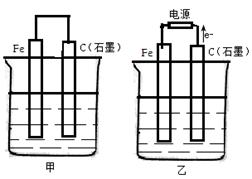 (1)若甲、乙两烧杯中均盛有NaCl溶液,则: ①甲中石墨棒上的电极反应式为 ; ②乙中总反应的离子方程式为 ; ③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 。若反应中Cl2和I2的物质的量之比为5∶1,且 生成两种酸,该反应的化学方程式为 。 (2)若甲乙两烧杯中均盛有足量CuSO4溶液,则: ①甲中铁棒上的电极反应式为 ; ②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是 (写化学式),其质量为 g。 |
参考解答
| (1)①2H2O+O2+4e-===4OH-; ②2Cl-+2H2O  H2↑+Cl2↑+2OH-, H2↑+Cl2↑+2OH-,③5Cl2+I2+6H2O===10HCl+2HIO3; (2)①Fe-2e-===Fe2+; ②CuO(或CuCO3) 0.8g或1.24g。 |
试题分析::(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-; ②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,则电解反应为2Cl-+2H2O  H2↑+Cl2↑+2OH-, H2↑+Cl2↑+2OH-,③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3; (2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+; ②由2CuSO4+2H2O  2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g。 2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g。 |
相似问题
相同材质的铁在下列情形下最不易被腐蚀的是(如下图) ( )。
相同材质的铁在下列情形下最不易被腐蚀的是(如下图) ( )。
下列说法正确的是( )A.钢铁发生电化学腐蚀时 负极发生的反应是:Fe-3e-=Fe3+B.将钢
下列说法正确的是( )A.钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-=Fe3+B.将钢铁与电源的正极相连,可防止其被腐蚀C.在镀件上镀铜时可用金属铜
下图是用铅蓄电池为电源 模拟氯碱工业电解饱和食盐水的装置图(C D均为石墨电极)。已知:铅蓄电池在放
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。已知:铅蓄电池在放电时发生下列电极反应负极 Pb+-2e-===PbSO4正
根据图示判断下列叙述符合事实的是A.按图①连接并放置一段时间后 Fe片表面会“镀”上一层铜B.按图②
根据图示判断下列叙述符合事实的是A.按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( ) A.a为负极 b
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( ) A.a为负极,b为正极B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析












