[物质与结构](12分)纳米技术制成的金属燃料 非金属固体燃料 氢气等已应用到社会生活和高科技领域。
[物质与结构](12分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
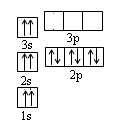 (2)ACl2分子的空间结构为 (用文字描述)。 (3)我国部分城市雾霾天占全年一半,引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,其中NO3-中N原子的杂化方式是 ,与SO42-互为等电子体的分子是 。 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其 晶胞如图所示,该物质在低温时是一种超导体。该物质的化学式 为 。  (5)继C60后,科学家又合成了Si60、N60, Si60分子中每个硅原子只跟相 邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。 |
参考解答
| (1)泡利不相容原理 (2) 直线型 (3) sp2 CCl4、CF4 等 (4) K3C60 (5) 30 |
试题分析:元素AB的第2和第3电离能相差较大,故两种原子最外层均为2个电子,但B的第一电离能小金属性强,故AB分别为Be和Mg。(1)该原子的s轨道均排了自旋方向相同的电子,故不符合泡利不相容原理;(2)BeCl2分子价电子对数为(2+2)÷2=2,故为sp杂化为直线型;(3)NO3-中氮的价电子对数为(5+1)÷2=3,为sp2杂化;SO42-互为等电子体的分子为CCl4、CF4 等;(4)该晶胞中黑球有12×1/2=6,C60有8×1/8+1=2,K原子和C60分子的个数比为3:1,化学式为 K3C60;(5)硅原子应形成4个公用电子对才能达到8电子稳定结构,但其只与3个原子成键,因此与其中一个原子形成双键,双键中含有1个π键,每个双键两个硅原子共用,计算为1×1/2×60 =30. |
相似问题
已知X Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子 Y元素原子的最
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z
部分中学化学常见元素的原子结构及性质如下表所示:(A-D为元素代号 与实际元素符号无关)(1)已知A
部分中学化学常见元素的原子结构及性质如下表所示:(A-D为元素代号,与实际元素符号无关)(1)已知A的单质与冷的浓硝酸作用发生钝化,则工业上冶炼A单
从原子 分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索 研究不同类型物质的有关性
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+ 2CO(NH2)2=4BN+Na2O +4H2O+2CO2↑,根据要求回答下列问
短周期中的三种元素X Y Z 原子序数依次减小 原子核外电子层数之和是5 X元素原子的最外层电子数是
短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和;Y元素原子的












