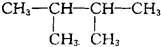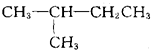参考解答
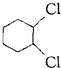
A.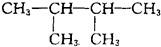 中不存在手性碳原子,故A错误; B. 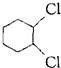 中与氯原子相连的两个碳原子都是手性碳原子,其他原子都不是手性碳原子,故B正确; C. 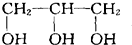 中不存在手性碳原子,故C错误; D.  中不存在手性碳原子,故D错误; 故选B. |
相似问题
(1)氢键可以表示为A-H…B 其产生的条件是A电负性大 它强烈地吸引氢的电子云 受体B具有能与氢
(1)氢键可以表示为A-H…B,其产生的条件是A电负性大,它强烈地吸引氢的电子云,受体B具有能与氢 原子强烈地相互作用的高电子云密度区(如孤对电子)。形
下列各组分子中 中心原子的杂化方式都是sp3杂化的是 [ ]A. CO2;H2S B. C2
下列各组分子中,中心原子的杂化方式都是sp3杂化的是 [ ]A CO2;H2S B C2H4;CH4 C BCl3;C2H2D NH3;H2O
下列有关杂化轨道的说法不正确的是 [ ]A.原子中能量相近的某些轨道 在成键时能重新组合成能
下列有关杂化轨道的说法不正确的是 [ ]A.原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道B.轨道数目杂化前后可以相等,也可以不等
在乙烯分子中有5个σ键 一个π键 它们分别是 [ ]A.sp2杂化轨道形成σ键 未杂化的2p
在乙烯分子中有5个σ键、一个π键,它们分别是 [ ]A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
下列说法中错误的是[ ]A.SO2 SO3都是极性分子 B.在NH4+和[Cu(NH3)4]
下列说法中错误的是[ ]A SO2、SO3都是极性分子 B 在NH4+和[Cu(NH3)4]2+中都存在配位键 C 元素电负性越大的原子,吸引电子的能力越强 D 原子晶体中原