前四周期元素A B C D E F 原子序数依次增大 其中A和B同周期 固态的AB2能升华;C和E原
| 前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子的一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题: (1)元素电负性:D______E (填>、<或=) (2)A、C单质熔点A______C(填>、<或=) (3)AE4中A原子杂化轨道方式为:______杂化;其固态晶体类型为______. (4)F的核外电子排布式为______;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中F与NH3之间的化学键为______. (5)氢化物的沸点:B比D高的原因______; (6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示.该晶体中阳离子和阴离子个数比为______,晶体中每个Xn-被______个等距离的C+离子包围. 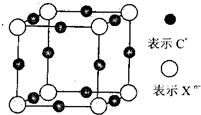 |
参考解答
| 前四周期元素A、B、C、D、E、F,原子序数依次增大,A和B同周期,固态的AB2能升华,AB2为CO2,则A为碳元素,B为氧元素;E原子的一个电子后3p轨道全充满,则E最外层电子数为7,故E为氯元素;C和E原子都有一个未成对电子,C+比E-少一个电子层,则C为钠元素;D的最高化合价和最低化合价代数和为4,D最外层电子数为6,D原子序数大于钠元素小于氯元素,故D为硫元素,其最高价氧化物SO3中S的质量分数为40%,且核内质子数等于中子数,符合题意;F为红色单质,广泛用于电气工业,F为铜元素. (1)D为硫元素,E为氯元素,同周期自左而右,元素电负性增强,所以电负性D<E. 故答案为:<. (2)A为碳元素,B为氧元素;碳单质金刚石为原子晶体,氧气形成分子晶体,所以熔点A>C. 故答案为:>. (3)A为碳元素,E为氯元素,AE4为CCl4,碳原子最外层电子全部成键,成4个C-Cl键,碳原子杂化轨道数为4,采取SP3杂化,属于分子晶体. 故答案为:SP3;分子晶体. (4)F为铜元素,核外电子数为29,F的核外电子排布式为1s22s22p63s23p63d104s1;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体为[Cu(NH3)4SO4?H2O,晶体中铜离子与NH3之间的化学键为配位键. 故答案为:1s22s22p63s23p63d104s1;配位键. (5)B为氧元素、D为硫元素,对应氢化物为水与硫化氢,水分子间存在氢键,增大分子间作用力,所以氢化物的沸点:B比D高. 故答案为:水分子间存在氢键,增大分子间作用力. (6)由CnX晶体的最小结构单元可知,该晶体晶胞中Xn-数目为8×
故答案为:3:1;6. |
相似问题
在有机物分子中 若某个碳原子连接着四个不同的原子或原子团 则这个碳原子称为“手性碳原子”凡是只有一个
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子称为“手性碳原子”凡是只有一个手性碳原子物质一定具有光学活性,物质有光学
根据杂化理论回答下列问题。(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?__
根据杂化理论回答下列问题。(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?_______________________________(2)NH3和H2O的键角为
下列物质中 难溶于CCl4的是[ ]A.碘单质B.水 C.苯 D.甲烷
下列物质中,难溶于CCl4的是[ ]A.碘单质B.水 C.苯 D.甲烷
下列两分子的关系是[ ]A.互为同分异构体 B.是同一物质C.是手性分子D.互为同系物
下列两分子的关系是[ ]A.互为同分异构体 B.是同一物质C.是手性分子D.互为同系物
1919年 Langmui提出等电子原理:原子数相同 电子数相同的分子 互称为等电子体。等电子体的结
1919年,Langmui提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。此后,等电子原理又有所发展。例如












