根据杂化理论回答下列问题。(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?__
| 根据杂化理论回答下列问题。 |
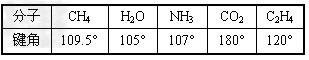 |
| (1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键? _______________________________ (2)NH3和H2O的键角为什么比CH4小?CO2的键角为何是180°?C2H4的键角又为何是120°? _______________________________ |
参考解答
| (1)表中所给物质中心原子都是以杂化轨道与其他原子成键的。 |
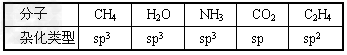 |
| (2)NH3和H2O分子中N和O原子都是采取sp3杂化,但有的杂化轨道中由原子本身的孤对电子占据着,电子云密度大,对其他成键的电子的杂化轨道有排斥作用,所以NH3和H2O的键角被压缩而小于109.5°。CO2分子中C原子是以sp杂化的,形成两条sp-pσ键,分子为直线形。在C2H4分子中,两个C原子都采取sp2等杂化,两原子各以一个sp2杂化轨道相连形成sp2-sp2σ键;另外每个C原子各有一个未参加杂化的p轨道,与sp2杂化轨道平面平行,“肩并肩”形成π键,所以C与C之间是一个双键(一条σ键,一条π键);每个C原子剩下两个sp2杂化轨道分别与H原子的s轨道形成sp2-sσ键,所以C2H4分子中C-H键的键角为120°。 |
相似问题
下列物质中 难溶于CCl4的是[ ]A.碘单质B.水 C.苯 D.甲烷
下列物质中,难溶于CCl4的是[ ]A.碘单质B.水 C.苯 D.甲烷
下列两分子的关系是[ ]A.互为同分异构体 B.是同一物质C.是手性分子D.互为同系物
下列两分子的关系是[ ]A.互为同分异构体 B.是同一物质C.是手性分子D.互为同系物
1919年 Langmui提出等电子原理:原子数相同 电子数相同的分子 互称为等电子体。等电子体的结
1919年,Langmui提出等电子原理:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。此后,等电子原理又有所发展。例如
在有机物的分子中 若某个碳原子连接着四个不同的原子或原子团 这种碳原子称为“手性碳原子”。凡有一个手
在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性,物质有光学
分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是[ ]A.只含非极
分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识不正确的是[ ]A.只含非极性键的分子一定是非极性分子B.含有极性键的分子一定是极












