[物质结构与性质](15分)已知X Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢
| [物质结构与性质](15分) 已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。 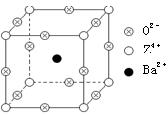 (1)Y在周期表中位于______________;Z4+的核外电子排布式为______________; (2)X的该种氢化物分子构型为___________,X在该氢化物中以___________方式杂化。X和Y形成的化合物的熔点应该_____(填“高于”或 “低于”)X的该氢化物的熔点。 (3)①制备M的化学反应方程式是________________________________________; ②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的______; ③在M晶体中,Z4+的氧配位数为________; |
参考解答
⑴第四周期 第ⅡA族;1s22s22p63s23p6;⑵直线形;sp;高于;⑶①TiO2+BaCO3 BaTiO3+CO2↑②面心;③6 BaTiO3+CO2↑②面心;③6 |
| 试题分析:根据题意可知:X是C,X的一种1:1型常见既有σ键又有π键气态氢化物分子是C2H2.Y是Ca;Z是Ti。(1)Ca在周期表中位于第四周期 第ⅡA族;Z4+的核外电子排布式为1s22s22p63s23p6;(2)X的该种氢化物分子C2H2构型为直线形;C在该氢化物中以sp方式杂化。X和Y形成的化合物CaC2是离子化合物,而C2H2的则是有分子构成的分子晶体。由于在离子化合物中离子间以离子键结合,而后者则是有分子通过分子间作用力结合的所以熔点CaC2应该高;(3)①制备M的化学反应方程式是TiO2+BaCO3  BaTiO3+CO2↑;②根据晶体结构可知,在M晶体中,含Ba:1;含有Ti:8×1/8=1;含有O:12×1/4=3.所以该晶体的化学式是BaTiO3。在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,③在M晶体中,由晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,所以Ti4+的氧配位数为6个。 BaTiO3+CO2↑;②根据晶体结构可知,在M晶体中,含Ba:1;含有Ti:8×1/8=1;含有O:12×1/4=3.所以该晶体的化学式是BaTiO3。在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,③在M晶体中,由晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,所以Ti4+的氧配位数为6个。 |
相似问题
科学家发现铂的两种化合物a和b:实验测得a和b具有不同的特性。a具有抗癌作用 而b没有 则下列关于a
科学家发现铂的两种化合物a和b:实验测得a和b具有不同的特性。a具有抗癌作用,而b没有,则下列关于a、b的叙述正确的是 [ ]A a和b属于同一种物质 B a和
下列关于晶体的叙述错误的是( )A.在金刚石网状结构中 由共价键形成的最小碳环上有6个碳原子B.在
下列关于晶体的叙述错误的是( )A.在金刚石网状结构中,由共价键形成的最小碳环上有6个碳原子B.在氯化钠晶体中,每个钠离子的周围与它最近且等距离的
Q R X Y Z为前20号元素中的五种 Q的低价氧化物与X单质分子的电子总数相等 R与Q同族 Y和
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。(1
乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。(1)互为等电子体 的电子式可表示为___
乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。(1)互为等电子体,的电子式可表示为____________;1mol 中含有键的数目为_____________
在纳米级的空间中 水的结冰温度是怎样的呢?为此 科学家对不同直径碳纳米管中水的结冰温度进行分析。下图
在纳米级的空间中,水的结冰温度是怎样的呢?为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温












