(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源 具有广泛的开发和应用前景。(注:“
(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(注:“原子经济性”是指,在化学品合成过程中,合成方法和工艺应被设计 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中) 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)(1)工业上一般采用下列两种反应合成甲醇 反应I: CO(g) + 2H2(g)  CH3OH(g) ΔH1 CH3OH(g) ΔH1反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2 CH3OH(g) + H2O(g) ΔH2上述反应符合“原子经济”原则的是: (填“I”或“Ⅱ”)。 (2)已知在常温常压下: ① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O  (g) ΔH =-1275.6 kJ·mol-1 (g) ΔH =-1275.6 kJ·mol-1② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ·mol-1 ③ H2O(g) = H2O(l) ΔH =-44.0 kJ·mol-1 请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 __________________________________________________ (3)甲醇—空气燃料电池,电解质溶液是:20%~30%的KOH溶液。请写出甲醇—空气燃料电池放电时正极的电极反应式。 。 (4)下图是一个电化学过程示意图。 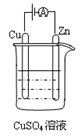 ①锌片上发生的电极反应式为 。 ②假设使用甲醇—空气燃料电池作为本过程中的电源,铜片的质量变化96g,则燃料电池理论上需要  mol甲醇。 mol甲醇。 |
参考解答
| 每空2分 (1) I (2) CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH =-442.8kJ·mol-1 (3) O2+2H2O+4e-=4OH- (4) Cu2++2e-='Cu ' 0.5 mol |
| 略 |
相似问题
某些化学键的键能数据如下表所示(kJ·mol-1):键H-HBr-BrI-ICl-ClH-ClH-I
某些化学键的键能数据如下表所示(kJ·mol-1):键H-HBr-BrI-ICl-ClH-ClH-I[H-Br键能436193151247431299356分析上表中数据,下列结论正确的是A
下列判断正确的是A.氧化物中的氧元素一定呈 - 2价B.酸性氧化物可能是金属氧化物C.化学键只存在于
下列判断正确的是A.氧化物中的氧元素一定呈 - 2价B.酸性氧化物可能是金属氧化物C.化学键只存在于晶体中D.正四面体分子中键角不可能是600
(5分)下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):物质Cl2Br2I2HClHB
(5分)下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):物质Cl2Br2I2HClHBrHIH2能量(kJ)243193151432366298436根据上述数据回答下列问题:
已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol
已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-12C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1则反应TiO2(s)+2Cl2(g)+2C(s)=TiC
下列电子式书写正确的是( )A.氯化钠B.氨气C.NH4Cl的电子式D.硫化钠
下列电子式书写正确的是()A.氯化钠B.氨气C.NH4Cl的电子式D.硫化钠












