海水中含有丰富的化学元素 下面是某化工厂从海水中提取NaCl Mg(以MgCl2形式存在)和Br2(
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: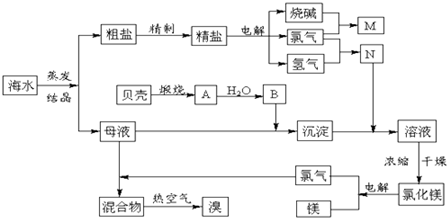 请回答: (1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为: A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液. 则加入试剂的顺序是(填编号)______. (2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是______. A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室 C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成 (3)写出电解饱和NaCl溶液的离子反应方程式:______. (4)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)______. (5)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是______. (6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:______. |
参考解答
| (1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为BDCA 或 CBDA 或BCDA等 故答案为:BDCA 或 CBDA 或BCDA等; (2)A、阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室,故A正确; B、阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确; C、阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,氢氧根离子浓度增大结合钠离子生成氢氧化钠,故C正确; D、.电解槽的阳极是石墨电极,溶液中的氯离子失电子生成氯气,若用用金属铁网制成,则铁是电子发生氧化反应,生成的亚铁离子和氢氧根离子形成沉淀,得不到氯气和烧碱,故D错误; 故选D. (3)电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;电解池中反应的离子方程式为:2Cl-+2H2O
(4)石灰石可以用作制玻璃的原料,发生的反应为:CaCO3+SiO2
(5)氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解); (6)溴单质具有氧化性,亚硫酸钠具有还原性发生氧化还原反应生成硫酸钠和氢溴酸;反应的化学方程式为:H2O+Na2SO3+Br2═Na2SO4+2HBr,故答案为:H2O+Na2SO3+Br2═Na2SO4+2HBr. |
相似问题
在盛有饱和碳酸钠溶液的烧杯里 插入惰性电极 接通直流电源 保持温度不变 一定时间后 溶液中( )A
在盛有饱和碳酸钠溶液的烧杯里,插入惰性电极,接通直流电源,保持温度不变,一定时间后,溶液中( )A.Na2CO3浓度减少B.Na2CO3浓度增大C.Na2CO3浓
如图所示 U形管中装入含有紫色石蕊的Na2SO4试液 通直流电 一段时间后U形管内会形成三色“彩虹”
如图所示,U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是[ ]A.蓝、紫、红B.
下列实验装置符合实验目的是( )A.粗铜的精炼B.验证电解NaCl溶液(含酚酞)的产物C.在铁质品
下列实验装置符合实验目的是( )A.粗铜的精炼B.验证电解NaCl溶液(含酚酞)的产物C.在铁质品上镀铜D.构成原电池
用石墨作电极 电解下列物质的水溶液 实质上与电解水一致的是( )A.NaOHB.NaClC.CuS
用石墨作电极,电解下列物质的水溶液,实质上与电解水一致的是( )A.NaOHB.NaClC.CuSO4D.CuCl2
O3可由臭氧发生器(原理如题图)电解稀硫酸制得。下列说法不正确的是[ ]A 图中阴极为B 电
O3可由臭氧发生器(原理如题图)电解稀硫酸制得。下列说法不正确的是[ ]A、图中阴极为B,电极反应2H++2e-=H2↑B、若C处通入O2,则A极的电极反应式为O2












